7) Vodík a kyslík
Created by Martin Krejzek
#Maturita

Deuterium
21H
Tritium
31H
Protonium
11H
Peroxid vodíku


Fyzikální vlastnosti vodíku
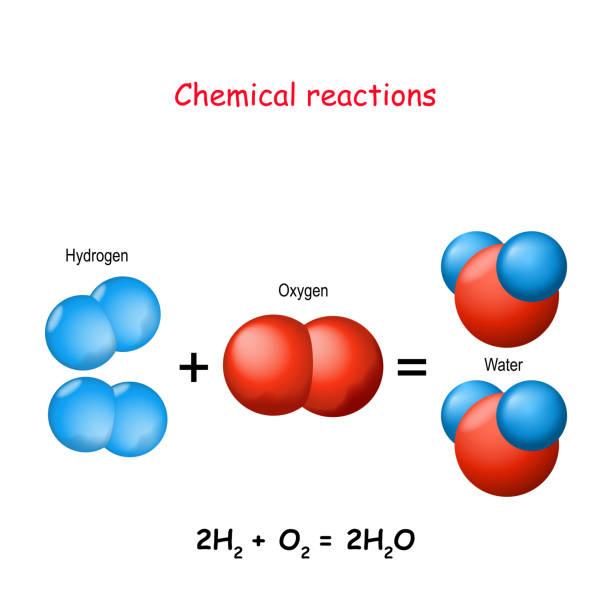
- Je to nejlehčí plyn
- Tvoří dvouatomové molekuly H2
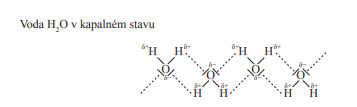
Voda


Chemické vlastnosti vodíku
- Atomy vodíku jsou reaktivní/nestabilní
- Protože nemá vyplněný celý orbital elektronama
- To ho činí velmi reaktivním a nestabilním (většinou se jedná o atomy s hlavním kvanotvým číslem 1-3)
- Bude stabilní, bude-li vytvářet interakce s jinými atomy
- Vytváří vodíkové můstky
- Vodíkové můstky jsou vytvářeny tím, že dva atomy vodíku (H) se spojují pomocí vodíkových vazeb
- V přírodě je ve formě
- Vázaného
- Volného
- Činidla
- Oxidační činidlo
- H2 = redukuje se z 0 na -1 => vzniká hydrid
- Redukční činidlo
- H2 = oxiduje se z 0 na +1 => vzniká proton vodíku
Co lenze rozdělit a není to polární?
Procvičení

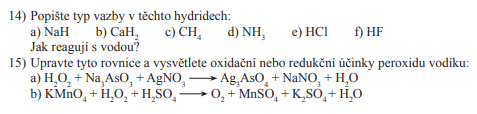
Oxidy
- Jestli jsou
- Kyslelinotvorné (SiO2)
- Na základě kyselinotvorného oxidu vznikají kyseliny (tvoří se z oxidů)
- Zásadotvorné (MgO)
- Na základě kyselinotvorného oxidu vznikají kyseliny (tvoří se z oxidů)
Amfoterní = chovají se jako zásada i kyselina

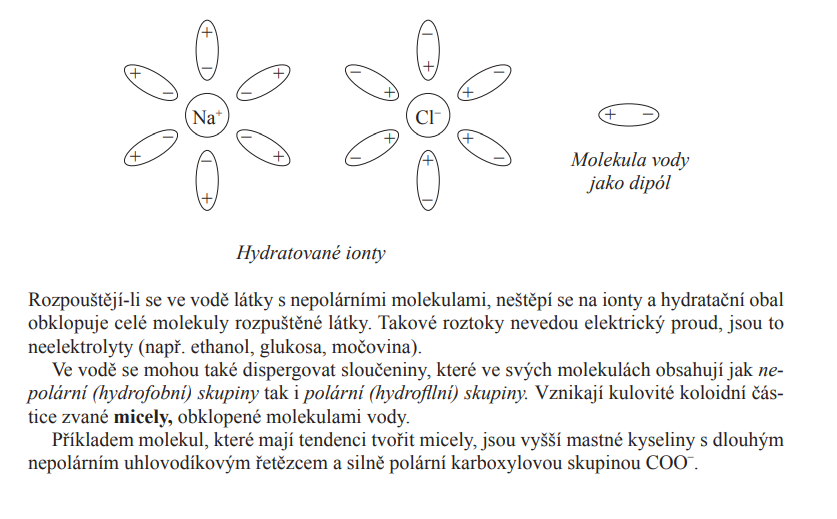
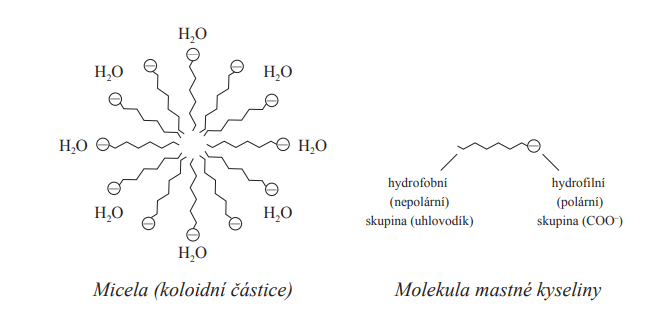
Voda
- Je polární
- To se pozná nejen kvůli parcialitě ale i schopnosti symetricky rozdělit prvek na 2 roviny (kaldnou a zápornou), voda nám to umožní ale alken třeba ne
- Proto je dobře rozpustná
- Voda se disociuje na vodík (H+) a hydroxyskupinu OH-
Chemické vlastnosti kyslíku
- Patří k nejsilnějším oxidačním činidlům
- Ano, samo se tím redukuje… nz 020 na -1 a -2
- Kyslík je jedním z nejsilnějších oxidačních činidel proto, že je schopen okamžitě reagovat s mnoha různými látkami. Může kombinovat s kovovými prvky, halogeny, organické sloučeniny a uhlovodíky, aby vytvářel oxidy
- To je stli je to redukční nebo oxidační se posuzuje dle čísla nahoře u prvků
- Budel i číslo kladné (vápník2+) ⇒ osštěpí elektrony (oxidace) a proto bude redukčním činidlem
- Kyslík (02-) ⇒ přijme elktrony 2 nebo 1 ⇒ oxidačním činidlem bude
- Má vysokou elektronegativitu


Vodík

- Je první člen PSP
- Elektronová konfigurace: 1s1
- Stabilní elektronová konfigurace: (musí se zaplnit všechny orbitally nebo odštěpit všechny elektrony)
- Přijme e- (H-)
- Odštěpí e- (H+)
- Spojuje se s kyselinou nebo vodou a vytváří H3O+
- Stabilní konfiguraci nejbližšího vzácného prvku helia mohou získat:
- Výskyt v podobě sločenin
- Biogenní prvek
Procvičení


Hydridy
- Viz binární sloučeniny
- Molekula hydridu (vodíku) + jiný prvek
- Např:chlor, dusík, kyslík atd.
Kyslík
- Elektronová konfigurace: 2s2 2p4
- Stabilní konfigurace:
- Přijme 2 e- k získání elektronové konfigurace vzácného plynu
- Iontové vazby = přijme 2 e- (X2-)
- Kovalentní vazby = elektrony sdílí
- Přijme 1 e- a vytváří peroxidy
- Kyslík se od ostatních chalkogenů liší tím, že nemá volné orbitaly, a proto je ve svých sloučeninách pouze dvojvazný
- 21 % ve vzduchu
- Biogenní prvek (nezbytný pro život)
Peroxid vodíku


Výroba vodíku
- Elektrolýzou vody
- H2O => H+ + OH-
- K: 2 H+ + 2e- => H2
- A: OH- - 1e- => H2O
- Nebo když metan reaguje s vodní párou při vysoké teplotě
- Připravit ho můžeme reakcí anorganické kyseliny s neušlechtilým kovem
Fyzikální vlastnosti kyslíku
- Je nejrozšířenějším prvkem na Zemi
- Součást mnoha organických sloučenin (kyseliny, alkoholy, aldehydy atd.)
- Je bezbarvý a bez zápachu
- Lze ho zkapalnit
- Dvouatom
Příprava kyslíku
- (Elektrolýzou vody)
- Rozkladem peroxidu vodíku
Výroba kyslíku
- Získává se průmyslově frakční destilací kapalného vzduchu
- Frakce = vzduch se zkapalní, zahřívá se => bod varu > vznik kyslíku
- Destilace = Účinkem tepla se oddělují jednotlivé složky
0zon
Kyslík
7) Vodík a kyslík
Izotopy
Sloučeniny vodíku
Kyseliny a soli
- Kyselina chlorovodíková
- Kyselina mravenčí
- NaHCO3
- KHSO4
Altropické modifikace
Sloučeniny kyslíku


