6) Elektrolýza
Created by Martin Krejzek

Příklady

- Při elektrolýze roztoku alkalického kovu vzniká na katodě vodík
- Tam se postupuje podle Beketovy řady
- Alkalické kovy jsou viz předchozí téma redukční činidla a proto se budou oxidovat
- NaClroztok = Na+ + Cl-
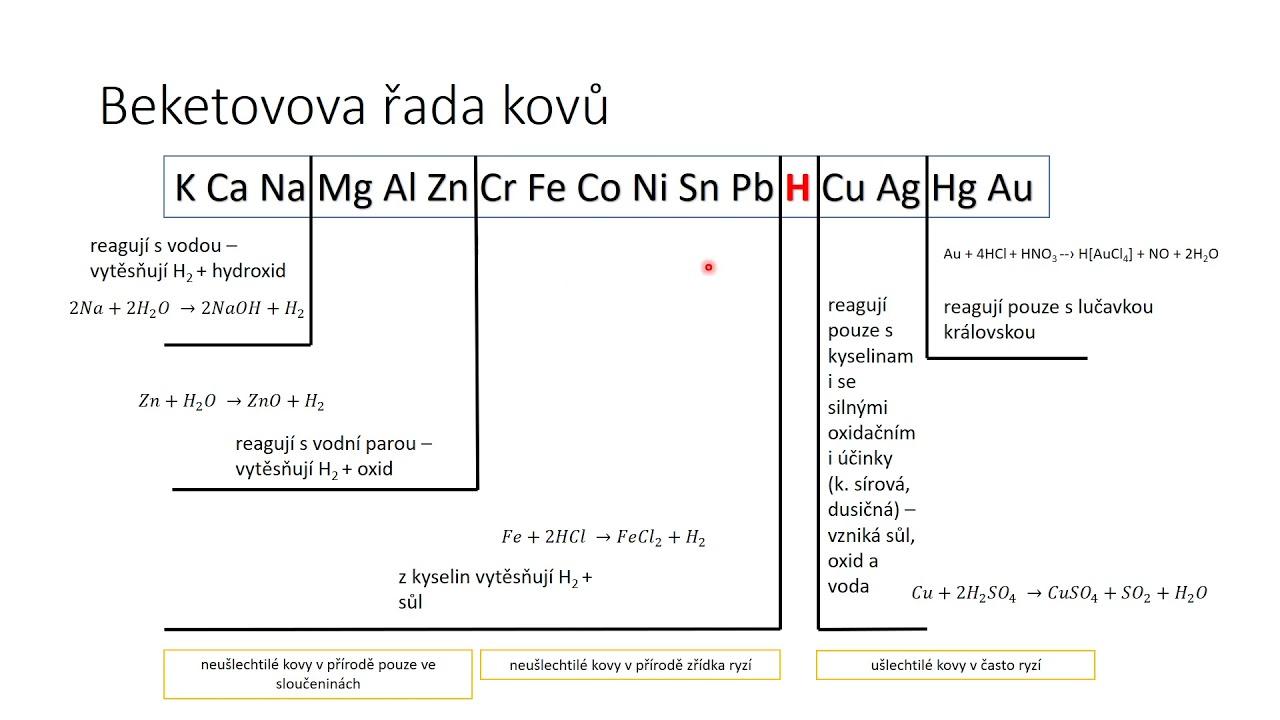
- Představím si Beketovu řadu kovů
- Vodík je uprostřed a snadněji, rychleji se redukuje a tto mi chcem
- Musíme najít prvek, který se bude na kattodě rychleji redukovat - proto H+
- K: 2H+ + 2 e > H20
- A: 2 Cl - 2 e- > Cl20
- Při elektrolýze taveniny alkalického kovu:
- NaCl
- (SO4)2-roztoku
- K: 2H+ > H2
- A: SO42-
- SO42- ⇒ HSO4 - | H2SO4
- H20 ⇒ H+ + OH-
- K-: Na+ + 1 e- => Na
- A+: Cl- - 1 e- => Cl2
- NaClroztoku => H+ + OH-
- Jestliže jsou ve sloučenině nějaké alaklické kovy, musíme postupovat podle becketovy řady
- Alkalické kovy jsou úplně vlevo
- Vodík je vůči nim oxidačním činidlem (je více vpravo)
- Bude redukován výrazně rychleji než sodík
- U maturity se nás zeptají jestli záleží na roztoku nebo tavenině
- Odpověď zní že záleží
- Hraje to roli hlavně u alkalických kovů, protože vznikají hydroxidy
Katoda
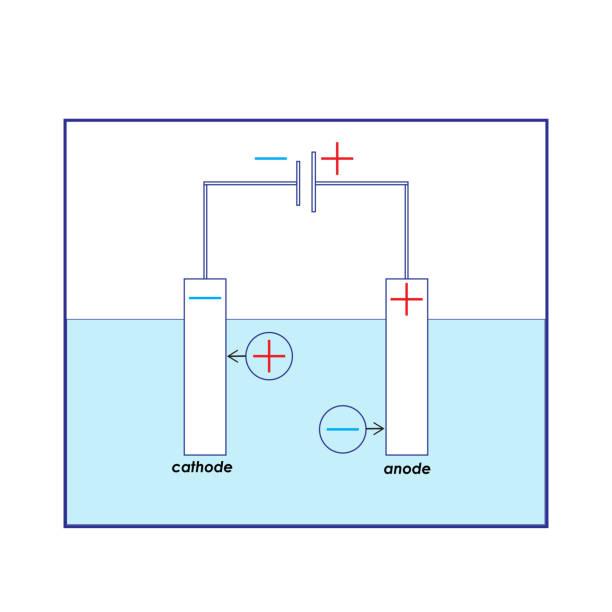
- Katoda = záporně nabitá elektroda (má nadbytek elektronů)
- Přitahuje kationty
- Probíhá tam redukce (tzv. katodická redukce)
- Látka tam totiž přijímá elektrony
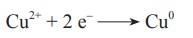
- Při elektrolýze solí se na katodě vylučuje čistý kov
Využití elektrolýzy
- Výroba některých prvků
- Výroba alkalických kovů z tavenin jejich solí,
- Výroba hliniku z roztaveného bauxitu
- Výroba H2, a O2 elektrolýzou vody
- Galvanizace (pokovování)
- Využívá se k ochraně kovů před korozi (kap. 23.1), např. chromování oceli
6) Elektrolýza
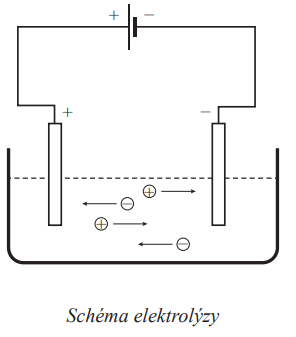
- Elektrolýza je rozklad disociovaných elektrolytů stejnosměrným elektrickým proudem
- Vycházíme z nějaké sloučeniny, kterou disocijujeme na jednotlivé ionty
- Je to oxidačně-redukční proces
- Elektrolyzovat můžeme roztoky nebo taveniny elektrolytů
- Tavenina je látka rozpuštěná v kapalině
- Elektrický proud přivádějí do roztoku dvě elektrody:
Anoda
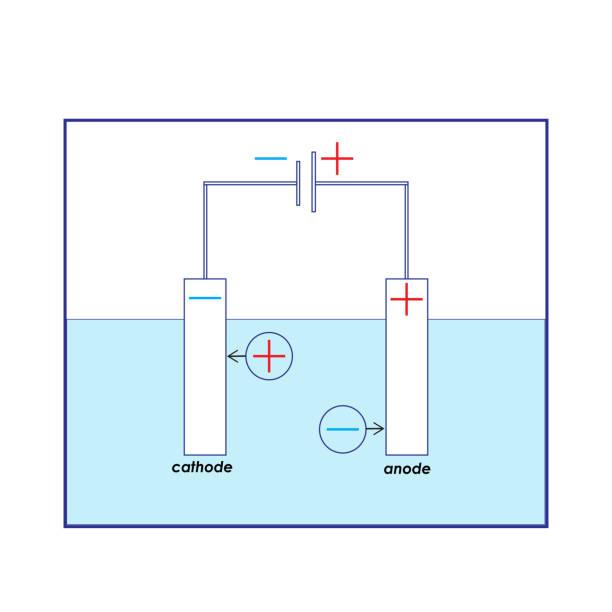
- Anoda = je kladně nabitá elektroda (má nedostatek elektronů)
- Přitahuje anionty
- Na anodě probíhá oxidace (anodická oxidace)
- Zde látka ztrácí elektrony
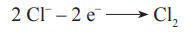
- Primární produkty, které vznikají na elektrodách, mohou dále reagovat např. s elektrodou nebo s rozpouštědlem
- Tak mohou vzniknout rozdilné produkty při elektrolýze taveniny a při elektrolýze vodného roztoku stejné látky
Elektrolyty a neelektrolyty


