41) Nitrosloučeniny a aminy
Created by Martin Krejzek

Nitrace
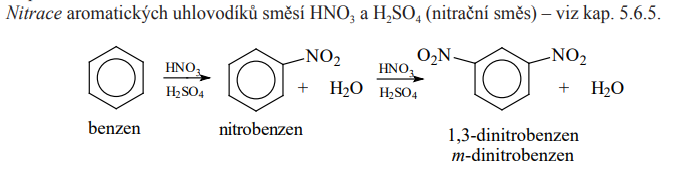
- Nitrační směs je právě elektrofilní
Chemické vlastnosti
- Nitroskupina je silně polární a má rezonanční strukturu
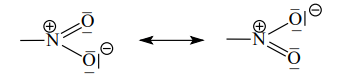
- Rozpustné ve vodě
- Aromatické
- Substituce elektrofilní
- Snadnost SE:
- Toluen ⇒ benzen ⇒ nitrobenzen
- Voní, jsou ale jedovaté
Fyzikální vlastnosti
- Jsou to pevné látky nebo kapaliny
Redukce
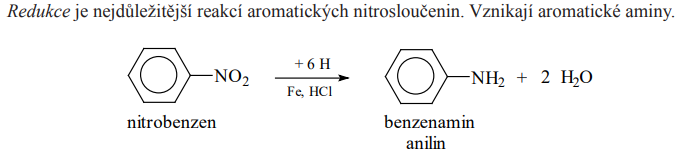
Acylhydroxylaminy
But-2-ylamin
CH3CHNH2CH2CH3
Pozor!

Nitrosloučeniny
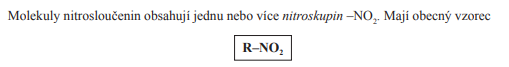
- V názvosloví používáme předponu:
- Takže to jsou nukleofilní činidla
Ethanamin/ethylamin
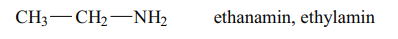
Nitrobenzen

Hexan-1,6-diamin
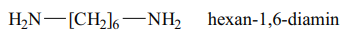
Fenylamin
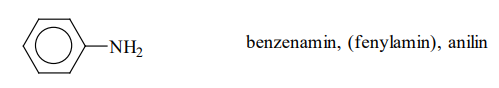
TNT
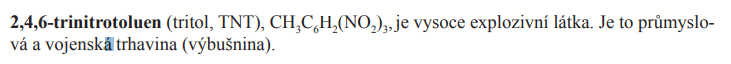
Nitroethan
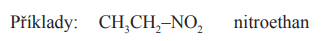
Trinitrofenol
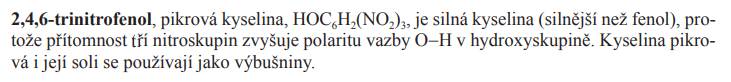
Naftalen-2-amin
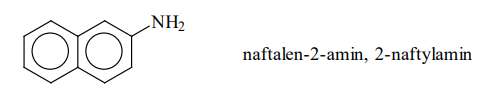
Aminy
- Vznikají náhradou vodíkových atomů v molekule amoniaku
- Podle počtu vodíků se dělí na:
Dimethylamin

Fyzikálně - chemické vlastnosti
- Mají zásaditý charakter
- Na dusíku je volný el. pár, na který se může vázat proton H+

- Aminy jsou silnější zásadou, mají větší parc. záp. náboj
- VBV
- Vodíkové můstky (s výjimkou terciálních)
- Jsou polární
- Rozpustnost
- Závisí nejen na polaritě ale i na délce řetězce a nevázaných substituentů v molekule
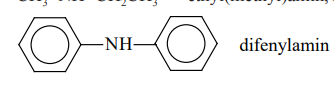
Difenylamin
Ethyl(methyl)amin
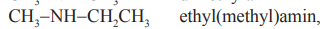
Trimethylamin

Ethyl(methyl)propylamin
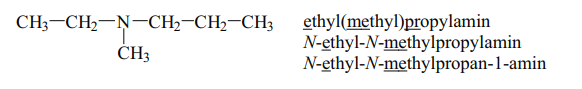
Ethyl(dimethyl)amin
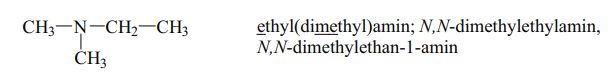
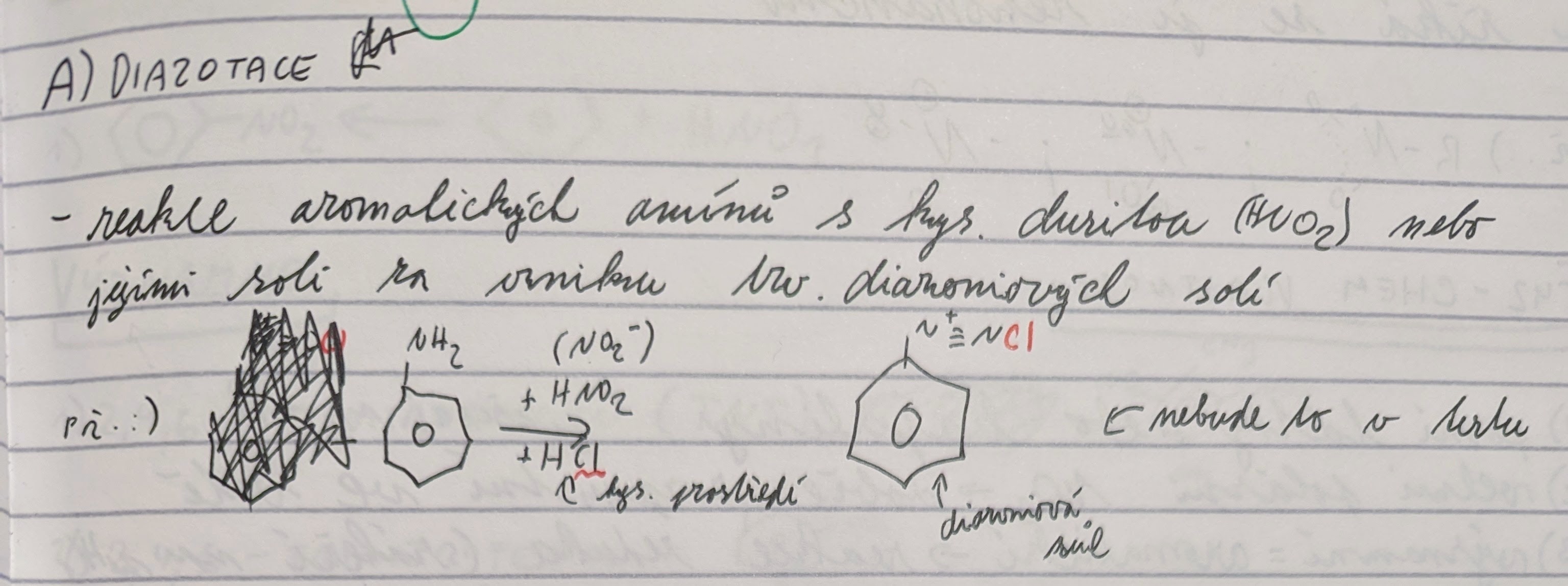
Diazotace
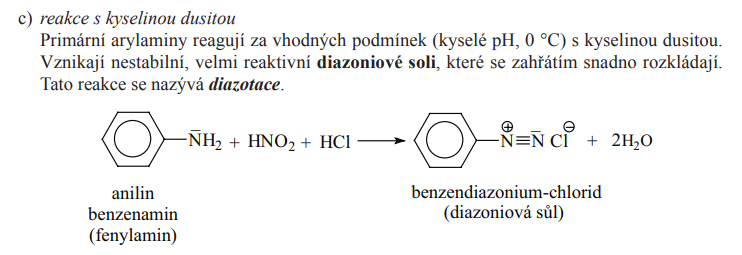
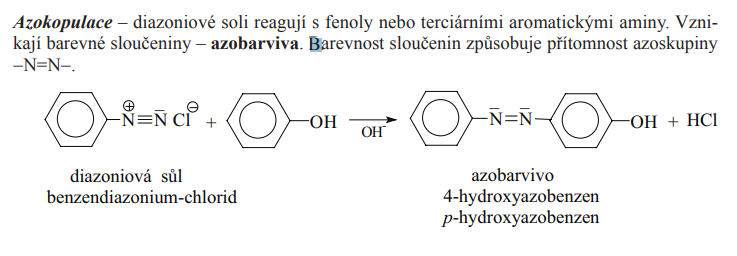
Kopulace
- Reakce diamoniovýcch solí a fenolů
41) Nitrosloučeniny a aminy
Příprava
Substituce elektrofilní
Chemické reakce
Rozdělují se dle pH
Neutrální pH
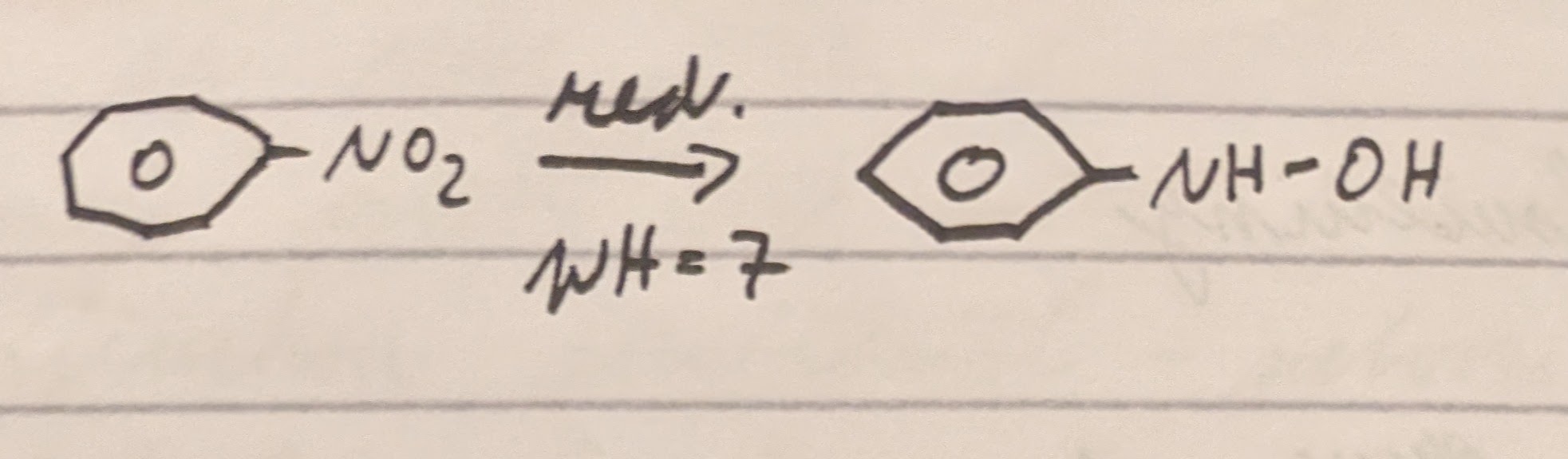
Zásadité pH
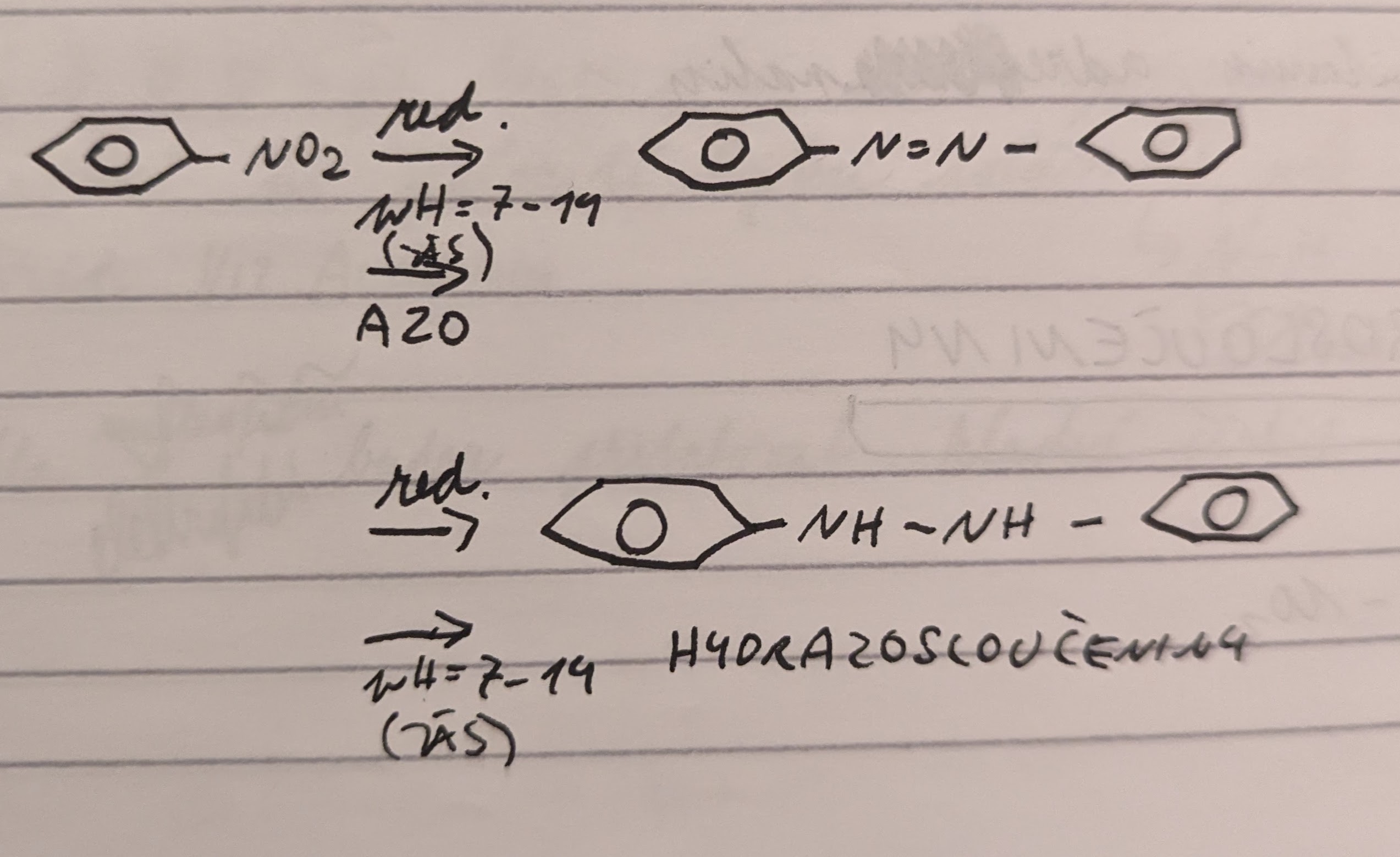
Kyselé pH
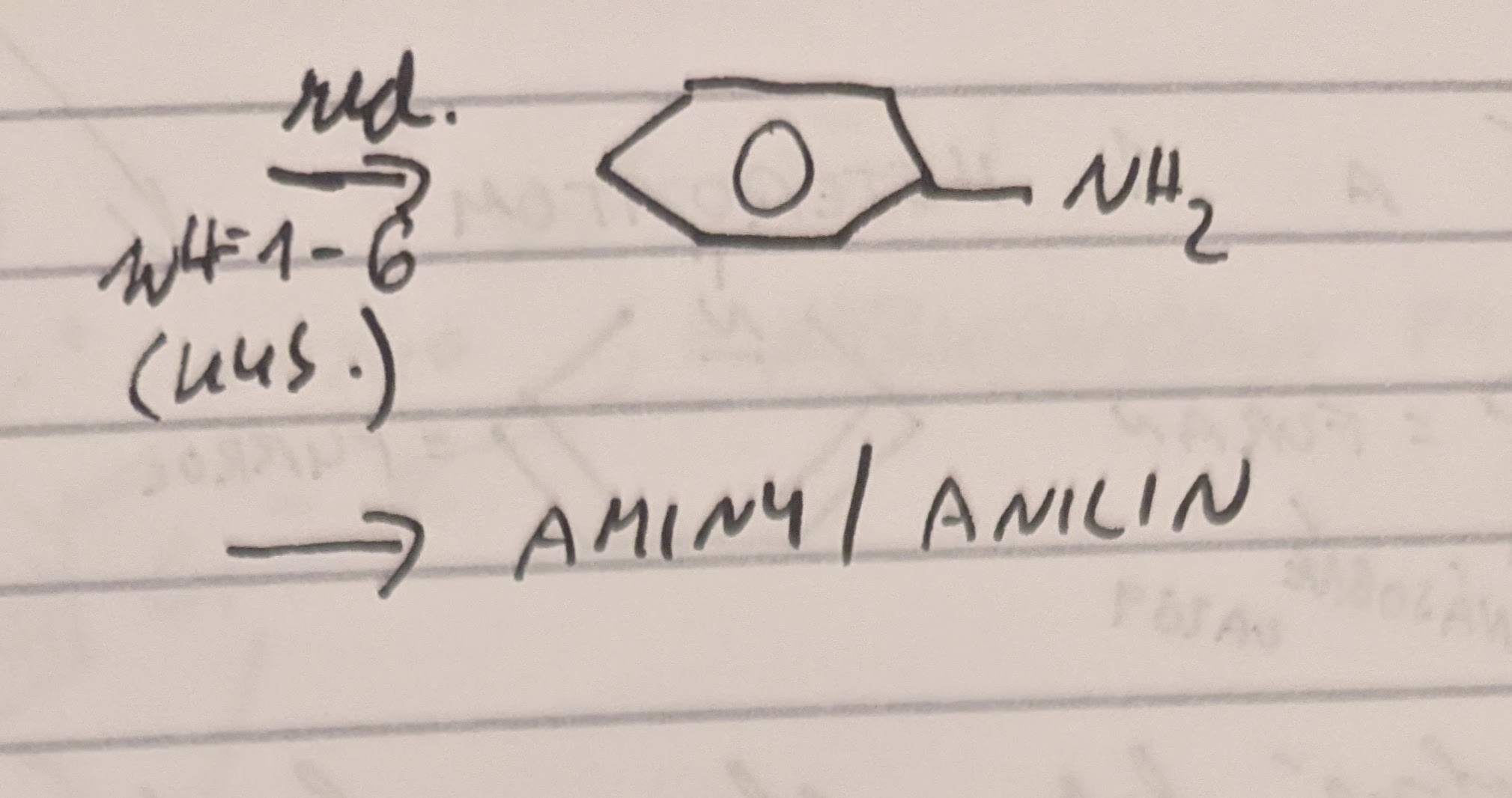
Významné nitrosloučeniny
Klasifikace
Primární aminy
Sekundární aminy
Terciální aminy
Chemické reakce
Substituce elektrofilní