Created by Kamila Klavíková
Kombinace zápisků z různých přednášek. Vytvořené jako příprava ke státnicím.
GABA. Dekarboxylace kyseliny glutamové na cystein.
Histamin. Dekarboxylace histidinu.
Dopamin. Dekarboxylace tyrosinu a jeho hydroxylace hned vedle již existující hydroxyskupiny.
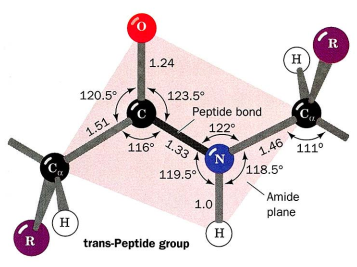
Peptidová vazba je vazba mezi dvěma molekulami aminokyselin. Váže se aminová skupina z jedné molekuly s karboxylovou skupinou z druhé molekuly.
Vazba mezi O=C a N-H má částečně dvojný charakter, proto nemůže volně rotovat.
Konfigurace cis se vyskytuje v 10 % vazeb v prolinu, protože je výhodnější. Jinak obecně je konfigurace cis méně energeticky výhodná.
 |  |
Rozeznáváme 20 základních aminokyselin tvořících proteiny. Existují 2 zvláštní aminokyseliny nevznikající posttranslační modifikací:
Při pH = 7 tvoří všechn mlk volné aminokyseliny zwitterion.
Zwitterion je molekula, která obsahuje kladný i záporný náboj v různých částech molekula, ale je celkově neutrální.
Atomy Cα všech aminokyselin kromě glycinu mají čtyři substituenty.
Kovalentní vazby v proteinech – peptidová – amidová vazba mezi aminoskupinou jedné AK a karboxyskupinou druhé. Cysteinová vazba mezi 2 cysteiny – S-S vazba.
Primární struktura – spojení planárních C-N systémů (ve kterých vazby C=O a N-H směřují do opačných vrcholů rovinného obrazce) pomocí Cɑ uhlíků s připojenými R skupinami.
PRotein infectION
Nositelem infekce je zřejmě špatně složený protein. Tento se propaguje tak, že při kontaktu se správně složeným proteinem indukuje je přeskládání na prionovou formu, obvykle obsahující amyloidový sklad.
Amyloidový sklad agreguje do fibrilárních řetězců se sekundární strukturou β skládaných listů. Rostoucí konce řetězce se mohou větvit a dát tak vznik novým řetězcům prionů.
Př. onemocnění: u zvířat BSE (bovinní spongiformní encefalopatie) a scrapie, u člověka CJD (Creutzfeld-Jakobsova choroba), kuru a další.
Proteom –obsah všech proteinů buňky, který vyjadřuje její biochemický potenciál. Obsah proteinů souvisí s transkriptomem, ale není identický. Obsah proteinů závisí také na rychlosti jejich transkripce a degradace (obratu proteinu v buňkách). Studium složení proteomu se nazývá protein profiling. Protein profiling postaven na proteinové elektroforéze a hmotnostní spektrometrii.
Proteinová elektroforéza – specifika. Isoelektrická fokusace – gel může být v pH gradientu, protein doputuje do pH, které je stejné jako jeho pI (izoelektrický bod, kdy se kladné a záporné náboje proteinu vyrovnají). SDS – sodium dodecyl sulfát lze využít k denaturaci proteinů a jejich obalení homogenním nábojem → proteiny jsou pak rozdělené podle svých velikostí. Dvojrozměrná elektroforéza – nejdříve provedena isoelektrická fokusace, a posléze proteiny denaturovány v SDS a po otočení gelu o 90° je puštěna SDS-PAGE.
Hmotnostní spektrometrie. Peptide mass fingerprinting – pomocí MALDI-TOF hmotnostní spektrometrie jsou peptidy ionizovány a na základě doby průletu hmotnostním spektrometrem je určeno jejich mass-to-charge poměr, z kterého lze odvodit jejich molekulovou hmotnost, a odtud odhadnout strukturu. MALDI-TOF funguje jen pro peptidy o velikosti do 50 amk, proto proteiny nejdřív štěpeny proteázou na fragmenty.
Často třeba porovnat rozdílné množství proteinů ve dvou proteomech. Označím proteomy dvěma různými fluorscenčními značkami, a poté je rozdělím 2d elektroforézou a osvěcováním gelu za různých vlnových délek porovnám množství daného proteinu v obou proteomech. Přesnější metoda: K obou proteomům přidány ICAT tagy (isotope coded affinity tag), tyto tagy se liší v přítomnosti buď obyčejného vodíku, nebo deuteria. Při použití MALDI-TOF můžu rozlišit stejné proteiny z dvou různých proteomů podle přítomnosti deuteria ve značce, a porovnat jejich relativní množství podle relativní intenzity signálu z MALDI-TOF spektrometru.
Lokální prostorová struktura polypeptidu vycházející především ze vzájemného uspořádání planárních C-N systémů peptidové kostry polypeptidu, stabilizovaná vodíkovými můstky a absencí sterického bránění R skupinám.
Různé R skupiny AK v peptidovém řetězci spolu interagují, a tak nutí peptidový řetězec, aby zaujmul sekundární, respektive posléze terciární strukturu.
Šroubovicovitá sekundární struktura daná opakováním stále stejné kombinace torzních úhlů.
Nejznámější pravotočivý ɑ helix – jediný helix stabilně v proteinech na delších úsecích. Aminokyseliny nejsou uspořádané přesně nad sebou. 3,6 AK na obrátku. Mezi kyslíkem C=O na n a vodíkem NH na n+4 AK je vodíková vazba, tyto vodíkové vazby podél osy helixu stabilizují ɑ helix, dále stabilizován díky tomu, že uprostřed něj není místo pro vodu, tudíž zde místo pro elektrostatické van der Waalsovy interakce. V pravotočivém helixu dále míří R skupiny více ven od peptidové kostry než by tomu bylo u levotočivého helixu. Určité R skupiny (např. příliš velké blízko sebe, stejně nabité blízko sebe) můžou helix destabilizovat. Často hydrofobní helixy na jednu stranu, hydrofilní na druhou. ɑ helix může z každé strany interagovat s jiným proteinem, jiným prostředím.
Relativní helikální tendence – některé AK mají větší tendenci tvořít ɑ helix, některé menší. Lze změřit na základě kontrolovaných výměn R skupin v rámci ɑ helixu. Histidin, asparagin, threonin, valin jsou s ɑ helixovou strukturou méně kompatibilní.
Prolin je pak zcela nekompatibilní s ɑ helixovým uspořádáním, ale tvoří polyprolinový II helix. Velmi prudce točený – 3 AK na obrátku, ale posun o 9,4 Å (onstrém). Levotočivý. Zásadní pro strukturu kolagenu.
loops
Extendujeme-li peptidový řetězec k torzním úhlúm blízkým 180°, a přiložíme-li 2 takové řetězce k sobě, aby mezi jejich C=O a NH skupinami vznikly vodíkové vazby. V β listu obvykle 6 takových řetězců přiložených k sobě a o delce 6 zbytků (jsou to průměrné hodnoty).
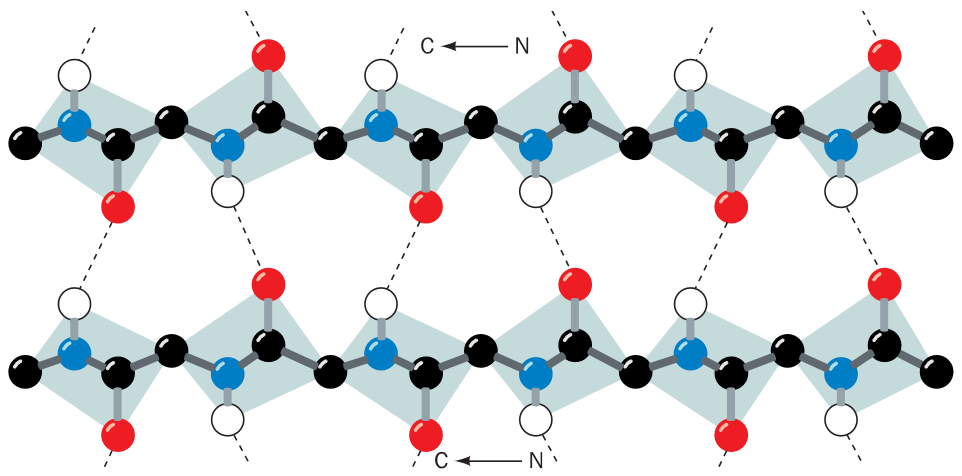 Antipararelní β listy
Antipararelní β listy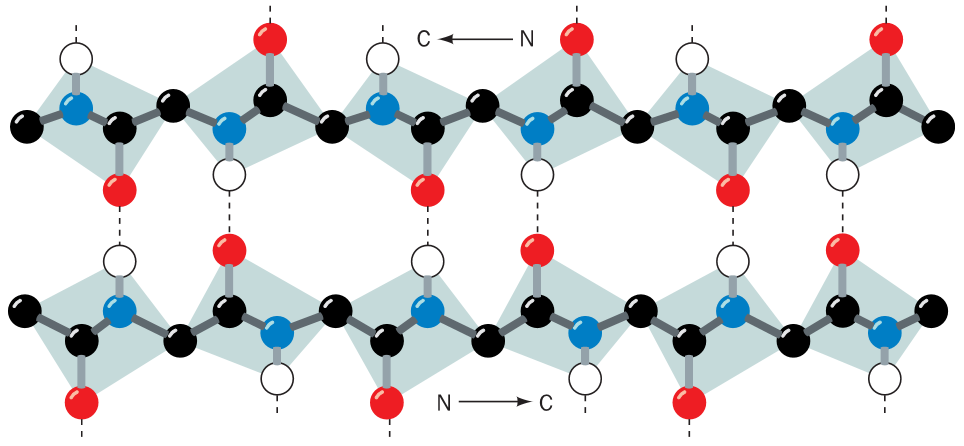
turns
Nativní konformace. Proteiny se liší svým uspořádáním v prostoru. Protein je funkční v této konformaci. Energeticky nejvýhodnější.
Celková struktura polypeptidu daná zejména hydrofobními silami, vzájemnými iontovými interakcemi R skupin, stabilizovaná dále disulfidickými a vodíkovými můstky. Terciární struktura se skládá ze supersekundárních struktur a z domén.
Proteolýza. Odstraňování proteinů, které se příliš pomalu či špatně balí/nebalí, nejsou správně asemblované, neasemblované, poškozené
Metionyl peptidázy odštěpují metionin z N konce amk (nebo formyl metionin), tím je protein destabilizován a rozpoznáván ubikvitin ligázou. Acetylace na N konci stabilizující faktor.
Ubikvitin – proteazómový systém. Ubikvitin ligáza rozpozná špatně složený protein, který vystavuje své hydrofobní sekvence do cytosolu, nebo protein, který postrádá na N konci (formyl)metionin, a naváže na jeho lysiny ubikvitiny. Ubikvitinylovaný protein rozpozná proteazóm, vychytává jej a degradativně štěpí.
Na zvýšené nežádoucí množství proteinu v určité situaci může také reagovat proces, který protein fosforyluje a takto jej opět destabilizuje a zprostředkuje ubikvitin ligáze.
Kvartértní struktura je počet a uspořádání mnoha složených podjednotek proteinu v jeden komplex. Stabilizace prostřednictvím hydrofobních interakcí, disulfidických můstků, iontových interakcí, vodíkových můstků.
Fibrilární proteiny. ɑ-keratin tvoří coiled-coil dimery 2 ɑ-helixů, tedy levotočivé nadšroubovice dvou pravotočivých ɑ helixů (s posunem na obrátku v ɑ helixu 5,1 Å, tedy méně než ve volném ɑ helixu), přičemž střídání orientace zvyšuje mechanickou pevnost. Tyto dimery se k sobě přikládají ve struktuře vyššího řádu tvoříce protofilamenta. Protofilamenta tvoří mikrofibrily, ty makrofibrily a makrofibrily vyplňují buňky, které keratin vytváří → rohy, nehty, atp. Fibroin – pro fibrilární strukturu nyní základem β skládaný list, mezi antipararelními řetězci jsou prokládany menší a větší R skupiny – zde alaninové a glycinové. Fibroin spolu se sericinem tvoří hedvábí – ohebná, ale neroztažitelná vlákna fibroinu (logické – β skládaný list).
Kolagen – levotočivý polyprolinový II helix tvoří trojitou šroubovici spolu s levotočivým polyglycinovým helixem. Kolageny skupina proteinů vytvářejících vlákna o různé pevnosti a dalších mechanických vlastnostech, obecně nejvíce abundantních proteinů v těle.
Globulární proteiny. Globulární polypeptidové podjednotky asemblují do funkčního supermolekulárního komplexu, někdy i s částmi RNA.
α domény jsou tvořeny svazkem 4 a více α helixů.
Př. lidský růstový hormon.
Polypeptidy o velikosti více než 200 aminokyselin tvoří globulární struktury zvané domény. Jsou strukturně autonomní, takže se protein může rozpadnout na jednotlivé domény zachovávající si svou strukturu. Zpravidla nesou nějakou funkci.
Pozorujeme je na konkrétních oblastech proteinů, ale jen jako součást něčeho většího – domén.
 | Dva β listy pravotočivě spojené s ɑ helixem. β listy v globulárních proteinech mají pravotočivý zkrut (způsoben R skupinami AK a souvisí s jejich L chiralitou), což může usnadňovat zaujetí pravotočivého spoje. |
Vše, co vede k přeměně nascentního proteinu (transitovaného polypeptidového řetězce) na aktivní formu.
Skládají se z rRNA a proteinů. Enzymová aktivita ribozómů vykonávana RNA molekulami, proteiny mají stabilizační funkci.
Mají podobnou strukturu u prokaryot i u eukaryot.
Prokaryota. Ribozómy 70S. Skládají se z malé 30S a velké 50S podjednotky. Malá podjednotka se sestává z 16 S RNA podjednotky navázané na 21 proteinů. Velká ribozomová podjednotka sestává se z 5S RNA, 23S RNA a 31 proteinů.
Eukaryota. 80S ribozóm, malá podjednotka 40S, velká 60S. Malá podjednotka 18S RNA a 33 proteinů, velká podjednotka 5S RNA, 5.8S RNA, 28S RNA a 46 proteinů.
Cytochrom c po uvolnění z mitochondrie aktivuje APAF1 (apoptotic protease activating factor) tak, že na jeho Card doméně hydrolyzuje deoxyATP na deoxyADP, které se posléze uvolní.
APAF se rozbalí a vystrčí tak Card (Caspase recruitment domain, na kterou se opět naváže nové deoxyATP), její místo zaujme cytochrom c.
APAF agreguje svými Card doménami do heptameru v podobě sluníčka, kde uprostřed 7 Card, a na okrajích 7 paciček „držících“ cytochrom c. Na Card domény se přichytí 7 kaspáz. Kaspázy 9 se autoaktivují a posléze aktivují i ostatní (efektorové) kaspázy.
Vzniklý heteroheptamer (7 kaspáz, 7 APAF) agreguje s druhým heteroheptamerem. Vzniká tak 28mer, kde kaspázy k sobě jako cívka z APAFů.
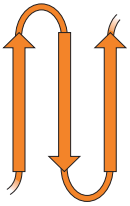
 | Dva β listy jedním směrem, oddělené mezi sebou, vlásenka je odděluje od dalších dvo β listů jdoucích opačným směrem, mezi sebou také oddělených; toto se přehne tak, že 1. a 4. a 2. a 3. β list vedle sebe. |
Chaperony (=HSP – heat shock proteins) – zejména v ER, katalyzují sbalení proteinu do biologicky aktivní konformace, obvykle rozpoznávasjí částečně sbalené proteiny, naváží se na hydrofobní části proteinu a dají mu čas, aby se zbalil. Jiné chaperony mohou udržovat protein rozbalený pro transport do mitochondrie, kde se jej chaperony pustí a jiné na něj nasednou a zbalí jej.
Chaperonin HSP 60 uzavírá protein do soudečku i s jeho hydrofobními sekvencemi, kde se protein sbalí.
„Standardní“ spliceozom má 5 snRNA typů: U1, U2, U4-U6, které tvoří spolu s proteiny snRNP, tyto snRNP vytváří spliceozomový komplex, který se asembluje pokaždé znovu na nové pre-RNA.
Enzymy jsou proteiny s katalytickou funkcí. Vydá se jinou cestou, tím sníží velikost aktivační energie.
Důležité vlastnosti:
β domény jsou tvořené β listy. Dva složené β listy tvoří sendvič. Pokud budeme β list stáčet, bude mít tendenci se kroutit. Můžeme z něj vytvořit soudek (β-barrel). Velkým soudkem může procházet molekula vody.
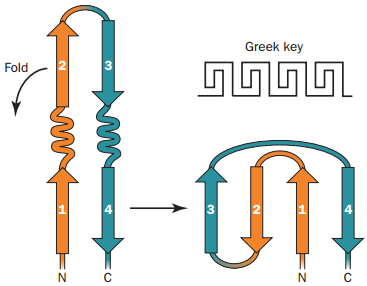
Př. membránové proteiny, kanály – poriny. Kombinace řeckých klíčů.
Kombinované s dalšími strukturami.
ɑ/β soudek
Je jedním z nejstabilnějších proteinových tvarů v přírodě.
Je vlastně z β listů, které jsou poskládané. Spojení od N k C mezi dvěma paralelními je realizováno helixem, když se to stočí do válce, vznikne uprostřed β řetězec, na povrchu probíhají ɑ-helixy, jsou vůči sobě pootočené.
Např. je součástí trióza-fosfát-izomerázy, ale i dalších struktur.
Selektivní transport mRNA do cytoplasmy.
Translace regulována také přes vazbu proteinů na 3D struktury v rámci 5’UTR a 3’UTR.
Modifikace postranních řetězců aminokyselin ještě když jsou navázány na aminoacyl-tRNA – jedná se o pre-translační/kotranslační modifikaci.
International comittee for enzymes při IUPAC – 4 stupně třídění enzymů – označovány čísly.
V nejvyšší úrovni třídění 6 základních kategorií enzymů.
Oxidoreduktázy - přenos elektronů - redukčních ekvivalentů z donoru na akceptor. Systematický název: donor:akceptor-oxidoreduktáza → CoQ: cytochrom c oxidoreduktáza (komplex III). Příklady: NADH dehydrogenáza, cytochrom c oxidáza, malát dehydrogenáza, sukcinát dehydrogenáza, alkohol dehydrogenza, laktát dehydrogenáza, glutathion peroxidáza, glutathion reduktáza, kataláza, superoxid dismutáza (dizmutace superoxidu na kyslík a peroxid vodíku je redox děj).
Transferázy - přenos funkčních skupin. Systematický název:donor:akceptor skupina-transferáza → ATP:hexóza-fosfotransferáza (hexokináza). Příklady – metyltransferázy (HMT – metyluje histony→ silencing genů, DAM metyltransferáza metyluje adeniny DNA, využívají SAM jako koenzym), glykosyl transferázy (glykogen syntáza, větvící enzym), kinázy (fosfotransferázy – pyruvát kináza, bisfosfoglycerát kináza), acyltransferázy (malonyl-CoA:ACP acyltransferáza, acetyl-CoA:ACP acetyltransferáza – z komplexu FAS).
Hydrolázy – hydrolyticky štěpí substrát. Podtřídy podle typu substrátu, patří sem endonukleázy, exonukleázy, lipázy, fosfatázy, proteázy, glykosylázy (DNA glykosyláza – odebírá poškozené nukleotidy z DNA), helikázy (za spotřeby – hydrolýzy ATP rozmotávají DNA), F1FO ATP syntáza.
Lyázy – katalyzují nehydrolytické a neoxidační štěpení vazeb, často za vzniku vazeb nových (bez potřeby hydrolýzy ATP). Systematický název: substrát skupina-lyáza → oxalát karboxy-lyáza (oxalát dekarboxyláza). Příklady: Pyruvát dekarboxyláza, RuBisCO, PEP karboxykináza (dekarboxylace a fosforylace oxalacetátu na PEP během glukoneogeneze); hydratázy a dehydratázy – fumaráza, akonitáza, uhličitá anhydráza, enoláza (dehydratáza), enoyl-CoA hydratáza; adenylát cykláza.
Izomerázy - intermolekulární přestavby molekuly – izomerace. Systematický název: substrát typ izomerie izomeráza (nebo jen izomeráza) → fumarát cis-trans izomeráza (reakce na maleát). Příklady: Epimerázy (UDP-glukóza 4-epimeráza), PPIáza (peptidyl-prolyl cis,trans izomeráza, intramolekulární oxidoreduktázy (protein-disulfid izomeráza, trióza fosfát izomeráza), mutázy (fosfoglycerát mutáza), topoizomerázy (odstraňují nadvinutí DNA šroubovice).
Synthetázy (Ligázy) - při dodání energie z hydrolýzy ATP či jiného trifosfátu spojují dvě molekuly dohromady Systematický název: X:Y ligáza. Příklady: Aminoacyl-tRNA syntetáza; sukcinyl-CoA syntetáza, acyl-CoA syntetáza (β-oxidace MK); E3 ubikvitin ligáza, APF; pyruvát karboxyláza (glukoneogeneze), acetyl-CoA karboxyláza (syntéza mastných kyselin), DNA ligáza.
Změnou dostupnosti reaktantů. Jestliže budeme ubrat substrátubereme-li substrát, nebo přidáváme produkt, měníme ΔG a tedy rychlost reakce daným směrem. → Metabolické dráhy – produkty jedné reakce substráty reakce další, jsou tedy neustále odebírány, což reakci předchozí pohání žádoucím směrem.
Alosterická regulace. Postranslační modifikace enzymu může vést ke změně jeho Km a vmax, například fosforylace a systémy kináz a fosfatáz.
Regulační proteiny mohou ovlivnit specificitu enzymu k substrátu, navážou se na enzym a onhibují/aktivují jej.
Regulace koncentrace enzymu v buňce. Proteolytická degradace, up/down regulace genové exprese.
Změna konformace, struktury enzymu. Chaperony, částečná (procesivní) proteolýza (chymotrypsin – štěpenímjednoho polypeptidu vzniká trimer, prokolagen, proinzulin – štěpením polypeptidu vzniká dimer, další proproteiny).
Umístění enzymu. Enzym může být přenesen z kompartmentu s dostupným substrátem někam, kde substrát není, případně je odebrán a přemístěn substrát.
Metaloenzymy obsahují pevně výzané kovové ionty, nejčastěji Fe, Cu, Zn, Mn, Co.
Enzymy aktivované kovovými ionty jsou enzymy volně vážící kovové ionty z roztoku (a vyžadující je pro svoji aktivitu), např. ionty kovů alkalických zemin Na, K, Mg, Ca.
Proximitní efekt – přiblížení reaktantů. Orientační efekt – enzym zajistí zaujetí vhodné pozice reaktantů vůči sobě. Nukleofilní atak – atakující reaktant by měl být ideálně být v ose s vazbou, k jejímuž rozbití jeho nukleofilní atak povede. Příklad: opět hexokinázová reakce – 6’OH musí být správně natočen vůči γ fosfátu ATP, aby mohl nukleofilní atak 6’O na fosfát proběhnout.
Eliminace vody z aktivního centra vede ke snížení dielektrické konstanty a k zesílení elektrostatických interakcí. Uspořádání nábojů v aktivním centru stabilizuje přechodové stavy reakcí. Distribuce nábojů kolem aktivního centra přivádí substrát do centra rychleji než by tomu bylo prostou difuzí.
Přenos protonu od Brønstedovy kyseliny nebo na Brønstedovu zásadu snižuje volnou energii přechodového komplexu.
Typicky je součástí: hydrolýzy esterů, peptidů, reakcí fosfátových skupin, tautomerizací (keto-enol)
Příklad: hydrolýza RNA v rámci reakce rinonukleasy A
Enzym váže přechodový stav s relativně vyšší afinitou než substrát nebo produkt. Prefenční vazba přechodového stavu zvyšuje jeho koncentraci (pravděpodobnost výskytu) - to se odrazí ve zvýšení rychlosti reakce.