Created by Kamila Klavíková
Příprava ke státnicím bakalářského oboru bioinformatika na PřF UK z roku 2019. Státnice tvoří okruhy bioinformatika, biologie a matematika s informatikou.
Posttranslační modifikace, sbalení a kontrola kvality v drsném ER.
COPI váčky vrací proteiny z GA z5 do ER, pokud se tyto proteiny naváží pomocí KDEL sekvence cílící do ER. Takové proteiny jsou v GA omylem.
Struktura – síť cisteren, lumen ohraničené fosfolipidovou membránou, kontinuita lumen s perinukleárním prostorem. Možnost změny SER v RER a naopak.
Hladké (SER – smooth) – nemá ribozomy, syntéza fosfolipidů, skladování vápníku, poslední krok glukoneogeneze – defosforylace glukóza 6 fosfátu na glukózu glukóza 6 fosfatázou.
Hrubé (RER – rough) – má ribozomy, ty se připojují na translokon ER, pokud translatují protein určený signální sekvencí pro sekretorickou dráhu. Začátek N glykosylace.
Transport z ER do GA. Váčky obalené COPII proteiny. Váček se vytvoří, pokud na proteinech v lumen dost exit signálů.
Cis strana blíž Golgi, medial Golgi, trans strana dál od Golgi.
Dokončení N-glykosylace, O-glykosylace.
Fosforylace mannóz glykoproteinů určených do lyzozómů.
Syntéza polysacharidů a proteoglykanů.
Sulfatace sacharidů v rámci proteoglykanů.
Proteiny Golgiho aparátu – transmembránové, s N koncovou doménou v cytosolu, jedním alfa helixem a C koncovou doménou v cytosolu.
GAAP protein výhradně a Bcl-2 částečně v Golgi (Golgi anti apoptotic protein) – ochrana proti apoptóze neznámým mechanismem.
mezibuněčná hmota
Pojivová tkáň nesoucí mechanickou zátěž; sekretována buňkami pojivových tkání (prokolagen + kolagenáza = kolagen). Pevnost v tahu díky kolagenu → 3řětezcová helikální struktura; tvoří fibrily a pak složena ve vlákna.
Spojení buněk a matrix → fibronektin (jedna část vazba na kolagen a druhá na aktin filamenta v cytosolu).
Odolnost vůči tlaku díky gelům z polysacharidů a proteinů → proteoglykany (extracelulární), které jsou připojeny k negativně nabitým polysacharidům GAG = glukosaminglykany (hydrofilní a tvoří gely; - náboj přitahuje Na+ - do matrix nasáta voda – bobtnavý tlak vzniká – odolnost).
Jsou to kompartmenty s jednou membránou. Množí se dělením.
Jsou důležité pro β oxidaci mastných kyselin a pro metabolismus lipidů.
Dále pro detoxifikaci ROS. Kataláza oxiduje substrát za tvorby peroxidu vodíku. Peroxidáza další substrát oxiduje pomocí peroxidu vodíku za vzniku vody.
Glyoxyzómy. Provozují glyoxyoxalátový cyklus, kdy dochází k přeměně tuků na cukry. Nalezneme u olejnatých semen rostlin (př. slunečnice).
Glykozómy. Probíhá zde glykolýza. U kinetoplastid. V jaterních buňkách slouží ke skladování tuku.
Lyzozómy obsahují hydrolázy aktivni při nízkém pH, které je v lysozomech udržováno pomocí protonových pump.
Zásadní. Běžně asi 70 % objemu voda. Všechny biochemické reakce se vztahují k vodnému prostředi (ačkoliv některé se odehrávají v bezvodém prostředí). Při fotosyntéze je voda fotolyzována a při respiraci syntetizována.
Koncentrační poměry v buňce: Na+, Mg2+, Cl-, Ca2+ venku více, K+ a H+ více uvnitř. Vně více kladného náboje → elektrochemický gradient přes membránu. Membránový potenciál – napětí na polarizované polopropustné membráně. Osmotický tlak je tlak toku rozpouštědla pronikajícího přes semipermeabilní membránu do roztoku s vyšší koncentrací rozpouštěných molekul nebo iontů.
Překladiště, třídící centrum buňky.
Časný endozom – sortovací centrum buňky – co se dostane do buňky, tak zde je určeno, zda to půjde na nějaké místo určení, či bude degradováno v lysozomu. Na endozómu Rab GTPázy, které řídí pučení váčku z membrány poblíž nich, a tento váček má určený osud podle typu Rab GTPázy. Rab7 například přesunuje obsah váčku, který vytvoří, do pozdního endozómu.
Pozdní endozóm struktura, která skrze vezikulární transport komunikuje s trans Golgi, a dále také s lysozomem.
V časném či pozdním endozómu se receptor z ligandu uvolní a putuje zpět na membránu, LDL receeptor mnohokrát, ale insulinový receptor, či receptory pro růstové faktory putují zpět na membránu jen třikrát, poté do lysozómu → snížení citlivosti k hormonální regulaci.
Titrace. Stanovení neznámé koncentrace známého objemu vzorku – titru (titrandu) pomocí titračního standardu (titrantu). Slabou i silnou kyselinu vždy titrujeme silnou zásadou. Slabou i silnou zásadu vždy titrujeme silnou kyselinou.
Pufr. Konjugovaný pár kyseliny a nebo zásady a jejich soli, který je schopný udržovat v jistém rozmezí stabilní pH po přidání kyseliny či zásady do systému. Pufry jsou obvykle směsi slabých kyselin a jejich solí, nebo směsi slabých bází a jejich solí.
Endocytóza je proces, kdy je náklad z vně buňky transportován do endozómu, kde se rozhoduje, co s ním dál.
Váček = membrána + endocytovaný materiál navázaný na receptory + další látky
Fagocytóza. Obklopení materiálu panožkou, odškrcení membrány a vznik fagozomu. Požírání velkých kusů všeho možného.
Makropinocytóza. Vysunutí panožek, obklopení tekutiny a vytvoření váčku. „buněčné pití“ Prvoci, některé b. imunitního systému.
Klatrinové váčky. Klatrinové molekuly se složí jako fotbalový míč. Spuštění při navázání ligandu na příslušný receptor. Vazba ligandu vázaná na pH. Nejvíce prozkoumané.
Kalveoly. Stabilní lahvovité vchlípeniny. Transcytóza = odškrcení na jedné straně buňky a vyklopení obsahu na straně druhé, 2 možnosti: (a) pomocí kalveolů (př. cesta protilátek na povrch střeva, (b) endocytóza a pak exocytóza (př. transport glukózy přes střevo).
Exocytóza je proces, kdy je náklad pomocí váčků transportován vně buňky.
Váčky jsou specializované. Rozpoznávání přes SNARE (t- a v-; target a vesicular).
Po rozpadu obalu z coat proteinů se na povrchu veziklu objeví specifické integrální membránové proteiny V-SNARE. Na jedné z membrán se nachází odpovídající T-SNARE, a také SNAP25, zprostředkující fůzi. V-SNARE a T-SNARE – když se rozpoznají, zamotávají se do sebe za pomoci Rab GTPáz a přibližují k sobě váčky, aby mohly splynout. V-SNARE a T-SNARE spolu s SNAP25 jsou schopny samostatně zprostředkovat specifickou fůzi vesiku s žádoucí membránou. Ale pomalé – proto další proteiny.
Před SNARE interakcí vezikly zachytí cílová membrána pomocí tethering proteinů 2 typů – helikální proteiny (například Golginy přítomné na GA) a vícepodjednotkové proteiny (například TRAPP – transport protein particle).
Rab GTPázy – určují směřování veziklů z časného endozómu na další místa v buňce. Zprostředkovávají spojení V-SNARE a T-SNARE.
NSF protein hydrolyzující ATP a SNAP proteiny (Soluble NSF attachments proteins) umožňuje disociaci SNARE komplexu.
Na povrchu hodně glykolipidů – váží se na receptory jiných buněk. Obecně hodně ligandů a receptorů pro mezibuněčnou komunikaci.
Buňky v tkáních jsou propojené buněčnými spoji na jejich povrchu.
Plasmatická membrána → dvouvrstva fosfolipidů; reguluje tok látek mezi buňkou a prostředím
Buněčná stěna → složena z peptidoglykanu = mureinu; dává buňce tvar a ochranu; složení je rozdílné u gram pozitivních (peptidoglykan a polysacharidy; barví se fialově) X gram negativní (tenká vrstva peptidoglykanu a lipopolysacharidu; barví se růžově; odolnější)
Pouzdro = kapsula = glykokalyx → ochranný obal z bílkovin a polysacharidů; chrání před vyschnutím; virulentní faktor u nemocí působených bakteriemi
Bičíky = flagella → pro pohyb; 1 – více Fimbrie = pilli → chloupkům podobné útvary z proteinů; slouží k přichycení
Tight junctions – pevné (těsné) spoje – umožňují polarizaci membrány, nepropustné, proteiny těsně u sebe, sousední buňky tvoří dvojice claudinu s clarinem a occludinu s obludinem.
Neprodyšnost; spojení buněk tak, že kapalina s látkami zde neprochází; bariéra pro difuzi; role v udržení polarity buněk (zabrání difuzi membránových proteinů apikální domény membrány)
Adherens junctions – adhezivní spoje – tvořené kadheriny navázanými na aktin, utahovám aktinu se můžou buňky deformovat a zároveň deformovat své sousedy. Adhezivní síla kadherinů kontrolována aktinem.
Mechanická vazba; pojí svazek aktinových vláken buňky se svazkem druhé buňky.
Desmozomy a hemidesmozomy – buňky spojené proteiny s jinými buňkami (desmozomy), nebo s extracelulární matrix (hemidesmozomy), které navázané na jiné proteiny, které se váží na intermediární filamenta.
Desmosom → mechanická vazba; bodový spoj kotvící pevná intermediární vlákna dvou sousedních buněk
Hemidesmosom → kotví intermediární filamenta buňky k bazální lamině
Gap junctions – průchozí spoje, mezerový spoj – trubičky mezi buňkami, průchod molekul do 1 kDa (prakticky všichni druzí posli) → buňky mohou reagovat společně. Tvořené proteiny konexiny (mnoho druhů), tyto se seskupují do konexonů – homo- či heterohexamerů konexinů.
Vodivý; spoj dovolující rychlý průnik malých rozpustných molekul a iontů; štěrbinu mezi buňkami přemosťují proteiny konexony = u rostlin plasmodesmata procházející cytoplasmou a BS.
Plazmodezmy – průchozí spoje mezi rostlinnými buňkami – zkrze buněčnou stěnu kanálek cytoplazmy s ER.
Kadheriny → adhezivita regulována Ca2+ koncentrací; homofilní vazba; zprostředkují vazbu buněk k sobě;
Kadheriny adhezivních spojů (2 stejné molekuly kadherinů se k sobě vážou a zároveň připojují k cytoskeletárním vláknům; tvoří adezní pásy v apikálním konci buňky) + kadheriny desmosomů (jiné typy kadherinů uvnitř buňky připojeny k intermediárním filamentům – keratinům; tvoří pevnost v tahu) + CAMs + integriny (proteiny bazální PM; zprostředkují připojení hemidesmosomy) + selektiny (vazba na sacharidy)
CAMs
Integriny: jsou to proteiny bazální plazmatické membrány, vně se vážou k lamininu v bazální membráně a uvnitř ke keratinovým filamentům; zprostředkují připojení hemidesmosomy
Selektiny: molekula, která se váže na konkrétní sacharidy (lektiny – obecně se vážou na různé sacharidy)
Atomy, prvky + voda.
Proteiny. Amidová kostra a zbytky podle dané aminokyseliny: hydrofobní, polární, kladně a záporně nabité.
Lipidy. Triacylglyceroly (glycerol a MK), vosky (dlouhý alkohol a MK), steroly, sfingolipidy, fosofolipidy.
Sacharidy. Aldózy, ketózy, alditoly, aldonové kyseliny, aleuronové kyseliny a jejich deriváty. Monosacharidy, oligosacharidy, polysacharidy.
Nukleové kyseliny. DNA a RNA.
Proteoglykany. Proteinové linkery spojují polysacharidické řetězce.
Glykoproteiny. O-glykosilované či N-glykosilované proteiny.
Glykolipidy. Oligosacharid navázaný na lipid.
Lipopolysacharidy. Lipid navázaný na polysacharid.
Lipoproteiny. Lipidy asociované s proteiny, můžou putovat vodním prostředím.
Ribonukleoproteiny. Komplex proteinů a ribonukleových kyselin.
Prostorově čtyřstěn, úhel 104,5 °.
Fyzikální vlastnosti vody:
Vysoká hodnota dielektrické konstanty. S tím souvisí schopnost účinně separovat náboje. Dochází k oslabení elektrostatických interakcí. Rozpustnost polárních látek.
Vysoká měrná kapacita. Brání teplotním výkyvům (oceán, organismus).
Vysoké měrné výparné teplo. Vysoká účinnost ochlazování odpařováním vody.
Vysoké povrchové napětí. Využívá vodoměrka ke svému pohybu.
Vysoká vodivost.
Vyšší hustota vody ve srovnání s ledem (ten má krystalickou mřížku). Anomálie vody.
G proteiny – skrz membránu, 3 podjednotky ɑ, β, ɣ. Na ɑ podjednotku je navázáno GDP, podle toho se ty G proteiny jmenují, a také neaktivní receptor. Na podjednotkách ɑ, ɣ jsou sekvence CAPS, kde je přes cystein thioesterovou vazbou navázána izoprenylová kotva, která kotví ty podjednotky do membrány.
GS spřažený s adenosyl syntázou → syntéza cAMP.
GI → inhibice cAMP.
Gq spřažený s fosfolipázou C → v membráně zanořený fosfatidylinositol-4,5-bifosfát, odštěpí se fosfatidylinositoltrifosfát, který interaguje s kanálem na ER, dojde k vyplavení Ca2+ z ER. Ca2+ aktivuje proteinkinázu C. Ca2+ se váže na kalmomodulin, který se naváže na enzym, který aktivuje.
Eukaryota mají oproti prokaryotům sexuální rozmnožování, cytoskelet a eukaryotický bičík, jádro, organely, endosymbiotické organely (mitochondrie a chloroplasty), vesikulární transport, (lineární chromozomy), polyploidii, více druhů RNA polymeráz, translaci iniciují metioninem.
Prokaryota mají oproti eukaryotům: bakteriální bičík, peptidoglykan v buněčné stěně, cirkulární DNA, (plazmidy), translaci zahajují formylmetioninem, gramnegativní bakterie mají dvojitou buněčnou stěnu.
Jádro (obalené x neobalené) + jiný typ ribozomů (prokaryota 70S) + organely (prokaryota nemají MIT, plastidy, ER) + BS (prokaryota mají peptidoglykan x kytky celulosu) + mnohobuněčnost (jen u eukaryot) + schopnost vázat vzdušný N (prokaryota) + schopnost žít anaerobně + organizovanost eukaryot + syntéza RNA (prokaryota v cytoplasmě X eukaryota v jádře) + bičík (prokaryota z flagelinu X eukaryota tubulin) + dělení (prokaryota prosté X eukaryota mitóza a meióza) + jiná evoluční strategie
Jádra atomů stabilní. Vše se řeší na úrovni elektronů (orbitaly, minimální energie).
Elektrostatické interakce. Ve vodě nutně oslabeny, neboť molekuly vody se shlukují kolem ionů a permanentních dipólů (silná disociační konstanta vody).
Vodíková vazba (vodíkové můstky). Vodík navázaný na silně elektronegativní atom (F, O, N – donor vodíkové vazby) získává kladý náboj (disociace na proton). Jiný elektronegativní atom – akceptor vodíkové vazby. Voda vodíkové můstky zeslabuje, protože voda vytváří kompetující vodíkové vazby s atomy vodíku. Každá molekula vody tvoří 4 vodíkové můstky.
Van der Waalsovy interakce. Přechodný dipól, který může indukovat v elektronovém obalu sousedního atomu vznik dočasného dipólu s opačným nábojem. Mezi těmito dipóly pak vzniká velmi slabá interakce. Voda tyto interakce neoslabuje.
Hydrofobní reakce. Nepolární povrchy se snaží redukovat svůj kontakt s molekulami vody. Systém vodíkových vazeb.
V ledu má voda 4 vodíkové můstky, což je základ krystalové mřížky ledu. Hexagonální tvar je velmi stabilní a navíc má menší hustotu než voda.
Buňka je nejmenší dále nedělitelnou stavební jednotkou organismu.
Tonoplast polopropustná membrána; zásoba vody, barviv a skládka toho, co není potřeba; buněčná šťáva uvnitř; reguluje turgor buňky.
Prokaryotické buňky. Složena z peptidoglykanu = mureinu; dává buňce tvar a ochranu; složení je rozdílné u gram pozitivních (peptidoglykan a polysacharidy; barví se fialově) X gram negativní (tenká vrstva peptidoglykanu a lipopolysacharidu; barví se růžově; odolnější)
Rostlinné buňky. Drží tvar a chrání; pevnost; složkou celulosa polysacharid, tvoří kostru, která je doplněna hemicelulosou a pektiny; dřeviny mají lignin; u hub je to chitin; má ztenčeniny = plasmodesmy.
V sekretorické dráze se mění pH – od neutrálního pH v ER po mírně kyselé v Golgiho aparátu.
Transport buď anterográdní nebo retrográdní (zpětný).
Translokace proteinů přes membránu ER. Signální sekvence na N-konci. Kotranslační transport. Odštěpení signální sekvence signální peptidázou. Některé malé peptidy transportované posttranslačně pomocí chaperonů.
Transport z GA.
Membrány se skládají z fosfolipidů, proteinů a cholesterolu. Je to dvouvrstva. Každá vrstva má odlišné složení.
Fosfolipidy → glycerofosfolipidy = fosfoglyceridy (fosfatidylcholin; fosfatidylserin; fosfatidylinositol; fosfatidylethanolamin; syntéza v ER) + sfingolipidy (základem je ceramid; odvozeny od sfingosinu; např. sfingomyelin; syntéza v GA) + steroidy = cholesterol (amfipatický díky OH skupině, jinak z většiny hydrofobní; chybí v rostlinách a prokaryotech)
Tvoří dvouvrstvu fosfolipidů → hydrofóbní ocasy uvnitř X hydrofilní hlavy ven; stabilizace van der Waalsovými silami (mezi UV řetězci) + iontovými a vodíkovými vazbami stabilizace hlav k sobě; funkce membrán je příjem látek z okolí; import a export látek; pohyb buňky; ochrana; udržení tvaru;
Laterální difúze → tepelný pohyb; lipidy se točí kolem své osy a difundují lateráln; při snížený teploty klesá a membrána gelovatí; FRAP (fluorescence recovery after photobleaching → obnovení fluorescence); FLIP (fluorescence loss in photobleaching → svítíme na místo, dojde k vybělení; prověřuje pohyb molekul v membránách)
Fluidita → závislost na lipidovém složení, teplotě, struktuře; dlouhé nasycené MK → gelovité; krátké MK → fluidní (méně van der Waals); cholesterol způsobuje rigiditu membrány
Cytosolická vs. exoplasmická strana → PS a PE (více na vnější) X SM a PC (víc na vnitřní); cholesterol nastejno; flipázy → flipáza je ATPáza P typu přesunuje fosfolipidy zvenku dovnitř; flopáza ABC transporter zevnitř ven; skrambláza oba směry (enzymy umožňující přesmyk fosfolipidů)
Membránové mikrodomény → organizované úseky glykolipoproteinové; konzistentní k působení detergentů; usnadnění komunikace; organizační centra pro uspořádání signálních molekul; ovlivňují fluiditu
Glykolipidy → sfingolipidy + galaktolipidy
Transmembránové → mají cytosolickou a exoplasmickou doménu s hydrofilním povrchem; prochází skrze membránu = integrální; plní mnoho funkcí – receptory, pumpy, kanály; jsou amfipatické – hydrofobní část prochází membránou, hydrofilní na povrchu
Alfa helixy → pevně kotvené v membráně; interakce s postranními AA a MK řetězci; glykoforin A; receptory spojené s G proteiny (7 helixů; bakteriorhodopsin); aquaporiny (transport vody/glycerolu; tetramer)
Barely → typické u prokaryot a MIT a chloroplastů; tvoří soudek; poriny = trimery identických podjednotek
Kotvené na lipidech → kovalentně vázané na molekuly lipidů; hydrofobní segment v membráně
Lipidové kotvy → protein nevstupuje do membrány; cytosolická strana (acylace N konce navázáním myristolové a palmitové kotvy; prenylace C konce Cys zbytkem); exoplasmická strana (GPI = glykosylfosfatidylinositol na C konci)
Periferní → není kontakt s hydrofobním jádrem membrány; vázány nepřímo (interakce s jinými proteiny) X vázány přímo (interakce s hlavami)
Topologie proteinů: jejich orientace v membráně (lokalizace C a N konce); ustanovena během syntézy; proteiny s kovalentně vázaným UV přes Ser, Thr a Asp = glykoproteiny vždy oritentovány exoplasmicky
de novo → dojde k ní po autofagii (membrána shromážděna a fúzuje s lysosomem)
vznik z existujících membrán → vezikulárním transportem z jiných membránových kompartmentů nebo u mitochondrie pomocí přenašečů (není nutná energie; po koncentračním gradientu jdou přenašeče); přesun mezi listy membrány umožní enzymy flipázy; syntéza fosfolipidů na membráně hladkého ER – přenos přes Golgi do membrán buňky; během transportu zachována orientace membrán (vnější strana váčku bude cytosolická strana X vnitřek váčku extracelulární strana)
Lipidová dvojvrstva je propustná pro plyny + H2O + močovina + malé polární molekuly.
Koncentrace iontů → živočišné buňky mají nízkou koncentraci Na+ uvnitř, pumpuje se ven a udržuje se tak rovnováha osmotického tlaku; uvnitř nejvíc K+; vyváženo ionty s opačným nábojem venku hlavně Cl-; vnitřní strana membrány nese – náboj → tendence kationtů procházet dovnitř a aniontů ven; klidový membránový potenciál = výsledek ustanovení rovnováhy na základě koncentrace iontů
Elektrochemický gradient se ustanovuje na základě koncentrace iontů a určuje směr jejich toku. Protonmotivní síla vyjadřuje závislost aktivního transportu na elektrochemickém potenciálu (klidový -70 až -90 mV). Přenos iontů ionofory přes membrány volnou difúzí (valinomycin pro K+ atd.).
Transportní proteiny → ATP pumpy (ATPázy; aktivní transport; Na/K+ pumpa; specifické, ale pomalé) + přenašeče (po gradientu; rychlé a nespecifické) + kanály (voda a ionty po gradientu; usnadněná difuze; rychlé)
Membránový potenciál je rozdíl elektrických potenciálů dvou vodných roztoků iontů oddělených membránou. Membránový potenciál je společně s proton-motivní silou je klíčovou složkou všech transportních dějů na membráně.
Fosfolipidová dvojvrstva je dielektrická, což znamená, že na jedné straně membrány je jiný náboj než na druhé. Proto jsou membrány nepropustné pro ionty.
Napětí cytoplazmatické membrány je asi -150 mV. Záporné proto, že uvnitř buňky je více záporných iontů. Na tonoplastu vakuoly je -20 mV (vztaženo k cytoplasmě, takže uvnitř vakuoly je kladný náboj, protože je jako vnějšek buňky).
Dominantním zdrojem membránového potenciálu jsou elektrogenní protonové pumpy. Tvoří elektrický potenciál a také gradient protonů, tedy gradient pH. Pomocí membránového potenciálu můžeme vypočítat proton-motivní sílu dané membrány – ta je zdrojem koncentračního rozdílu protonů.
Proton-motivní síla umožňuje kvantifikovat potenciální energii H+. Zdrojem proton-motivní síly je koncentrační rozdíl protonů. Velikost pmf je přímo úměrná membránovému potenciálu a rozdílu pH.
Působí antagoniticky proti acetylaci.
Sumoylace (SUMO = small ubiquitin-like modifier), působí antagonisticky (protichůdně) k acetylaci, metylaci a fosforylaci histonů → inhibice transkripce
Acetylace je reverzibilní děj probíhající pomocí histonacetyltransferasy (HATs). Acetylují se pozitivně nabité AK (přednostně Lys), čímž se změní náboj. Chromatin se dekondenzuje (rozvolní) a dojde k aktivaci chromatinu.
Opačným dějem je deacetylace při níž se účastní reakce histondeacetylasy (HDACs). Dojde ke kondenzaci a umlčení (represi) chromatinu.
Přenašeče a pumpy
symport → glukoso-sodný v apikální části buněk střeva; antiport → Na+/H+; 1 iont přenášen po koncetračním spádu a 2. proti opačným směrem
Primární transport: energie ATP přímo využita k transportu látek přes membránu;
• P třída: Na+/K+ ATPáza → antiport 3Na+ ven a 2K+ dovnitř; vytváří záporny potenciál (vazba Na+ - fosforylace pumpy ATP – konformační změna – Na ven – K+ navázáno – defosforylace – K+ dovnitř); Ha+/K+ ATPáza → buňky epitelové v žaludku; tvorba žaludeční šťávy; Ca2+ = SERCA pumpa → pumpuje Ca2+ do SR a ER (zásobárny Ca2+; pumpuje ho dovnitř; vylití na podnět; ion se naváže s ATP – konformační změna – otevření – uvolnění ADP)
• V třída: vakuolární; vesikulární; generuje rozdílné pH; ATP hydrolýza spojená s transportem protonů
• F třída: F-ATPáza → ATP syntéza na úkor proton gradientu; mitochondrie, chloroplasty a bakterie; má Fo a F1 doménu a rotační motor; opak V ATPázy
• ABC přenašeče = ATP binding casette: přenáší různé molekuly (AA, fosfolipidy, peptidy, proteiny); 2 domény s vazebným místem pro ATP; tetramery/monomery; 2 transmembránové a 2 cytosolické domény – otevřeno na jednu či druhou stranu; CFTR = cystic fibrosis transmembrane regulator → chloridový kanál; mutace působí cystickou fibrózu; MDR = multiple drug resistance → nádorové buňky; brání likvidaci nádoru; za resistenci k lékům může gen kódující kanál glykoprotein-P
Sekundární transport: využit proton gradient vytvořený primárním transportem; proti koncentračnímu gradientu; energie není využita přímo k přenosu příslušné látky, ale k přenosu látky jiné
NaCl a KCl transport v ledvinových buňkách → NaCl a KCl přestup z lumen do epitelové buňky – K+ zpět – Na+ a Cl- a Cl- přestup (Cl- po gradientu; Na+ antiport s K+) do krve
Jednoduchá difuze → plyny O2 a CO2; malé polární molekuly; neprochází velké polární a nabité molekuly AA a ATP...
Usnadněná difúze → Uniport GLUT1 pro transport glukózy, tvoří hydrofilní kanál (12 transmembránových helixů), má dvě konformace; je regulován inzulínem (naváže se na receptor a GLUT1 ve vesikulem splývá s PM a zvyšuje se jejich koncentrace, pak se odstraňují endocytózou)
Kanály → velké protein komplexy z mnoha transmembránových helixů; alosterická regulace napětím/ligandem; poriny (beta barel; bakteriální) + aquaporiny (tetramer; podjednotky z 6 alfa helixů; voda prochází) +
iontové kanály (hydrofilní; úzké; selektivní díky tvaru a průměru; většina uzavíratelná) → draselný kanál (tetramer; neurony; obnovení akčního potenciálu; K+ ven) + acetylcholinem ovládaný kanál (ovládán ligandem; nikotinový typ má 5 podjednotek a váže 2 acetylch. X muskarinový typ je spojen s G proteinem) + sodný kanál (ovládán napětím; v klidu membrána polarizovaná → depolarizace a kanál se otevře a Na+ jde dovnitř)
Buněčná stěna → drží tvar a chrání; pevnost; složkou celulosa polysacharid, tvoří kostru, která je doplněna hemicelulosou a pektiny; dřeviny mají lignin; u hub je to chitin; má ztenčeniny = plasmodesmy.
Vakuola → tonoplast polopropustná membrána; zásoba vody, barviv a skládka toho, co není potřeba; buněčná šťáva uvnitř; reguluje turgor buňky.
Plastidy → 2 membrány; podmiňují autotrofní způsob života; vznik dělením, NE DE NOVO!; chloroplasty (fotosynteticky aktivní; ctDNA jejich; probíhá zde energetický metabolismus; chlorofyl A s dalšími kombinacemi; thylakoidy tvoří ATP a grana) + chromoplasty (fotosynteticky neaktivní; chloro se mění na chromo při stárnutí; xantofyly a karoteny) + leukoplasty (ve stinných částech rostlin; nemají barviva; hromadí škrob, oleje, proteiny...).
Peroxizómy → mebránové organely s oxidačními enzymy; vznik z ER; některé kytky (v semenech; př. slunečnice) mají glyoxysomy (specializované peroxizomy glyxylátového cyklu, které zpracovávají tuky).
Remodelaci chromatinu zprostředkují proteinové komplexy (SWI/SNF, NURD a další). Enzymatická remodelace prostřednictvím postranslačních modifikace, případně ATPázy způsobující sklouznutí nukleozómu na DNA, stáhnutí vlákna DNA z nukleozomů, změnu konformace jádra nukleozómu.
Polycomb, Trithorax komplexy
PcG (Polycomb Group) – DNA-vazebné enzymy modifikující histony, rozpoznávají geny v reprimovaném stavu a udržují represi. TrxG (trithorax Group) – transkripční faktory, enzymy remodelující chromatin, udržují geny v transkripčně aktivním stavu.
Poziční efekt – exprese genu se může podrobovat epigenetickému umlčovaní vlivem sousedního heterochromatinu (rozšíření heterochromatinu na přilehlé oblasti). Telomerický poziční efekt – geny přenesené do telomerických oblastí jsou umlčovány v důsledku rozšíření tzv. telomere silencing. Poziční efekt regulují supresorové Su(var) a enhancerové E(var) proteiny.
Metylace histonů se účastní metyltranferázy. Podle toho o jaký typ metyltranferázy se jedná, mohou inhibovat nebo aktivovat transkripci (kondenzují/dekondenzují chromatin). Nejvíce známá je metylace Arg a Lys (H3, H4). Příklady metyltransferáz:
Metylace histonů – metylace Arg, Lys (na histonech H3, H4). Zprostředkují ji metyltransferasy – PRMTa (protein-argininmetyltransferasy) – nepřímá reverze pomocí deiminasy argininu; HKMTs (histon-lysinmetyltransferasy) – reverze pomocí aminoxidasy. Různé typy metyltransferaz → kondenzace / dekondenzace chromatinu → aktivace nebo inhibice transkripce (efekt závisí také na pozici metylovaných AMK a interakci s dalšími proteiny).
Oddělit od sebe prostředí, což lépe umožňuje regulovat jednotlivé děje.
Zakoncentrovat enzymy různých reakčních drah a jejich substráty.
Snaha vytvořit částečně izolovaný systém – za účelem ovlivnění směru chemických dějů. Toto vytváření speciálních podmínek buňku stojí energii, a to v souladu s termodynamickým principem, tedy více volné energie buňka spotřebuje, než jí uloží do tvorby těchto izolovaných systémů. Část původně volné energie se uvolní jako energetický odpad – teplo.
Uvnitř kompartmentu buňka pomocí proteolýzy a regulace katabolických a anabolických dějů kontroluje složení komparmentu a průběh dějů zde. Selektivním transportem přes membránu kompartmentu buňka kontroluje, co jde z kompartmentu ven a co dovnitř.
Buňka sama je vlastně také kompartment.
Kovalentní modifikace DNA. Nejčastěji v CG párech na obou vláknech DNA → CpG ostrovy.
de novo metylace. Modifikace dosud nemetylované DNA (metylace nového vlákna při replikaci, templátové již metylováno dříve).
Uchování metylace. Metylace již metylované DNA (po replikaci, reparaci, modifikace CpG, CpNpG ostrovů.
Signály pro metylaci. Vysoce repetitivní tandemové sekvence, rozptýlené repetice. Metylace může vést k imprintingu (utišení alely na daném chromozomu, podle toho, zda alela utišená u otce či u matky – paternální/maternální imprinting).
Modifikace histonů – proteinových struktur chromatinu. Posttranslační modifikace, vede k rozvolnění chromatinu (→euchromatin), či naopak k jeho větší svázanosti (→heterochromatin), podle toho regulována exprese, ovlivněna vazba chromatin-vazebných faktorů. Histonový kód – kombinace poststranslačních kovalentních modifikací histonů a proteinů, které se na modifikované histony vážou, určení co bude a nebude transkribováno, histonový kód může být částečně přenášen na dceřinné buňky během replikace.
kinasy/fosfatasy
Nejvíce jsou fosforylovány AK Ser, Thr. Náboj se změní na negativní, čímž dojde k dekondenzaci chromatinu a následně k aktivaci genové exprese.
Fosforylace histonů – kinasy. Fosforylace Ser, Thr → změna náboje na negativní → dekondenzace chromatinu → aktivace genové exprese. Fosforylace H2A histonu → role při opravách dvouřetězcových zlomů DNA. Fosforylace/defosforylace koreluje s kondenzací chromatinu během mitózy a meiózy. Nejlépe prostudované jsou mitotické kinasy (CDKs), ty mimo jiné fosforylují H3 a H1 histony. Defosforylace = fosfatasy → kondenzace chromatinu.
Ubikvitinace – monoubikvitinace H2B → aktivace transkripce, monoubikvitinace H2A → inhibice transkripce. Deubikvitinace obstarávají specifické proteasy.
V rostlinách obvykle čočkovité útvary, 5-8 μm v průměru. V rámci řas velká diverzita morfologie chloroplastů. Některé chloroplasty mají výběžky – stromula ze základní oválné struktury – k lepší výměně metabolitů.
Chloroplast má alespoň 3 membrány (chloroplasty ze sekundární enosymbiózy mají více membrán. Vnější membrána, mezimembránový prostor, vnitřní membrána, stroma s thylakoidy uspořádanými do gran. Obě membrány původem ze sinice (G- bakterie). Vnější membrána polopropustná, projdou jí ionty a malé molekuly, poteiny přes TOC. Mezimembránový prostor – u glaucophyt se zde zachovala peptidoglykanová vrstva (muroplasty). Vnitřní membrána – reguluje vstup a výstup látek do stroma, TIC komplex pro přenos proteinů, syntéza MK, lipidů, karotenoidů.
Periferální retikulum – nařasená vnitřní membrána do trubiček + vezikly (zřejmě sloužící k transportu mezi thylakoidy a cytosolem). Retikulum slouží k zvětšení prostoru pro výměnu mezi stromatem a cytoplazmou.
Stroma – obdoba cytosolu sinice, nachází se zde nukleoidy plastidové DNA, ribozómy chloroplastu (specifické, jiné než u cyanobakterií), systém thylakoidů, plastoglobule (kulovité váčky obsahující lipidy a proteiny účatsnící se syntézy a metabolismu lipidů, obalené fosfolipidovou jednovstvou), škrobová zrna (v nich se akumuluje škrob) a mnoho proteinů. Ve stromatu probíhá kalvinův cyklus – protein RUBISCO.
U řas – pyrenoidy – obsahují škrob a naakumulované RUBISCO.
Thylakoidový systém – thylakoidy v granech, které navzájem spojují vzestupné šroubovité lamelární thylakoidy. Vnitřní prostor thylakoidů chloroplastu je kontinuální. Proteiny na membráně thylakoidů se v různých částech systému liší. Jsou zde proteiny zodpovědné za světelné reakce fotosyntézy –fotosystém I a II obsahují světlosběrné komplexy s chlorofyly a karotenoidy, které pohlcují energii a předávají ji elektronům. Elektrony jdou do elektrontransportního systému, který pohání přenos elektronů do vnitřku thylakoidů. ATP syntáza pak využívá koncentračního graientu k syntéze ATP.
C4 rostliny – specializované chloroplasty, v mesophylu mají chloroplasty thylakoidy uspořádané do gran, probíhá zde světelná fáze fotosyntézy, není zde RUBISCO, produkuje se ATP, NADPH a kyslík, CO2 je ukládán do C4 molekuly.V bundle sheath buňkách nejsou thylakoidy v granech, mají pouze fotosystém I, provozují cyklický oběh elektronů, čímž se produkuje ATPa toto ATP je využito do Calvinova cyklu. Oba typy chlorplastů mají velké periferní chloroplastové retikulum pro rychlejší transport metabolitů.
Plastidy. Proplastidy – nediferencované plastidy. Vývoj na etioplasty (chloroplasty dosud nevystavené světlu/postrádající světlo) a pak na chloroplasty. Z chloroplastů se můžou stát chromoplasty – syntéza a skladování pigmentů. Stárnoucí chloroplasty – gerontoplasty. Proplastidy se můžou vyvíjet také na leukoplasty – bezbarvé plastidy pro syntézu monoterpenů, tyto se dále můžou specializovat na: 1) amyloplasty – syntéza a skladování škrobu, 2) elaioplasty – skladování tuku, 3) proteinoplasty – pro skladování a modifikace proteinů.
Struktura genomu. Název – cpDNA, ctDNA, plastom. DNA je kruhovitá či lineární, obvykle obsahuje kolem 100 genů (včetně RUBISCO), invertované repetice. Obvykle celá genová sada chloroplastu tvoří jeden kruh či lineární dvoušroubovici (x Dinophyta – až 40 kroužků). 1 chloroplast – 15 – 100 kopií ctDNA, po několika agregují do nukleoidů – HC (histone-like chloroplast protein) pomáhá s jejich pakážováním..
Specifické modifikace proteinových komplexů asociovaných s chromatinem
Specifické interakce RNA – DNA (RNA interference aj.)
Nemají v sobě energii uskladněnou na dlouhou dobu (jako lipidy a sacharidy), ale energii rychle dostupnou pro pohon reakcí.
NTP. Sloučeniny s pyrofosfátovou vazbou.
Fosfageny.
Thioestery.
kvašení
Fermentace oxiduje NADH, konvertuje ho na NAD+, aby mohla glykolýza pokračovat.
Enzymy berou pyruvát z glykolýzy a redukují jej na laktát nebo kyselinu mléčnou. Tato redukce je spřažená s oxidací NADH na NAD+ potřebný pro druhou fázi glykolýzy.
Probíhá v našich svalech, když máme nedostatek kyslíku (vzpírání, sprint). Kyselina mléčná se hromadí ve svalech a způsobuje únavu. Dopravuje se do jater, kde se metabolizuje na glukózu. Dále to využívají jogurtotvorné bakterie jako např. Lactobacillus nebo Acidophillus.
Enzym odštěpí karboxylovou skupinu z pyruvátu a vznikne acetaldehyd. Karboxylová skupina se přemění na CO2. V dalším kroku je acetaldehyd redukován na etanol redoxní reakcí, zatímco NADH je oxidován na NAD+ potřebný pro druhou fázi glykolýzy.
Využívají např. kvasinky (pivo, šampaňské, víno...).
Vědní podobor genetiky, který studuje změny v genové expresi (tedy obvykle i ve fenotypu), které nejsou způsobeny změnou nukleotidové sekvence DNA.
Princip ligace; na sekvenci napojujeme fragmenty – ligace – konec se rozzáří a odštěpí.
Schopnost odlišných fenotypů dědit se beze změny sekvence DNA. Přenos negeneticky kódované informace s nejistým, nestabilním výsledkem.
( Co odlišuje dvě sekvenčně identické alely? Jak je toto odlišení uchováno ve sledu generací? Jaký je podíl epigenetické informace ve vývoji jedince? Jak je možné, že dva jedinci se stejnou sekvencí DNA v lokusu, který kontroluje nějaký znak, mají odlišné fenotypy?)
cpDNA, ctDNA, plastom
DNA je kruhovitá či lineární.
100 – 120 genů (více než mt genom, včetně RUBISCO, geny pro rRNA, tRNA), invertované repetice, tandemové repetice. Obvykle celá genová sada chloroplastu tvoří jeden kruh či lineární dvoušroubovici (ale u Dinophyta – až 40 kroužků). 1 chloroplast – 15 – 100 kopií ctDNA, po několika agregují do nukleoidů – HC (histone-like chloroplast protein) pomáhá s jejich pakážováním. Jinak ctDNA nemá histony, nemá 5-metylcytozin, 71,5AT.
Replikace ctDNA: nezávisí na replikaci jaderné DNA, proteiny nutné pro replikaci mají jaderný původ, počet kopií ctDNA kolísá, má 2 počátky replikace. ctDNA částečně kóduje vlastní proteosyntetický aparát – 4 rRNA, 21 ribozomálních proteinů, 30 – 37 tRNA (wobbling) a vlastní RNA polymerázu. Přenos DNA mezi jádrem, plastidy a mitochondrií: není dokázán přenos z jádra do plastidu, k přenosu může docházet při dělení, při rozpadu, nebo při kontaktu (dotyku).
Apikoplast – organela homologická plastidům u parazitických Apicomplexa, matroklinní dědivost. Genom apikoplastu –kružnicová / lineární DNA, několik kopií, sekundární struktura DNA ve tvaru kříže (IR s geny pro rRNA), replikace rolling circle, ori uprostřed IR, nese geny pro RNA a proteiny účastnící se transkripce, translace.
Nukleomorf – zbytek jádra původního organismu po pohlcení v sekundární endosmybióze, vyskytuje se mezi vnitřní a vnější dvojicí buněčných membrán chloroplastů.
Cryptophyta, Chlorarachniophyta: nejvýznamnější organizmy obsahující plastidy ze sekundární endosmybiózy, 4 genomy (2 jaderné, 1 plastidový, 1 mitochondriální). Genom nukleomorfu: velikost cca 450-845 kb400 – 800 kbp (Cryptophyta), 380–450 kbp (Chlororarachniophyta), 3 chromozómy, na každém chromozómu rDNA operon, chromatin nekondenzuje do více než 20nm struktury, několik plastidových genů, stovky genů přeneseny během evoluce do jaderného genomu hostitele
Fotosyntéza má 2 fáze, světelná fáze a temnostní.
Reakce probíhají ve třech bílkovinných komplexech – fotosystému I, komplexu cytochromů b6/f a fotosystému II, které jsou propojeny pohyblivými elektronovými přenašeči. Tento přenos elektronů dostal název schéma Z, hlavní výchozí látkou je voda.
Kalvinův cyklus. Během Kalvinova cyklu enzym Rubisco fixuje uhlík, kombinuje CO2 s molekulou, která na začátku i konci cyklu, ribulózou bifosfát. Za fyziologických podmínek se jedná o energeticky nevýhodný proces. Je poháněný produkty světelých reakcí, ATP a NADPH. Nepotřebuje světlo, protože je chemicky poháněný. Produktem je glyceraldehyd-3-fosfát.
Fáze:
Výsledek: glycerol-3-fosfát, který se dá dále využít ke tvorbě energie.
„štěpení cukru“
Odehrává se v cytoplasmě.
3 fáze:
Výsledek: 2 NADP, 2 ATP a 2 pyruváty
Je v něm ukrytá energie.
Starší metody vyžadují větší množství molekul DNA. Nejprve je třeba DNA namnožit. Výsledkem sekvenování jsou krátká čtení o typické velikosti 30-400 bp v závislosti na technologii. Mezi často využívané metody tohoto typu patří Illumina a SOLiD. Nazývají se metodami sekvenováni druhé generace nebo sekvenování další generace. Jejich předností je vysoký dynamický rozsah úrovni exprese. Jsou tedy schopné detekovat transkripty s nízkou úrovní exprese. Dále mají vysokou úroveň reprodukovatelnosti. Mezi další výhodu patří nízký šum na pozadí.
Mitochondrie obsahují velké množství kopií mtDNA. Cirkulární nebo linearní. Mitochondriální genom je vysoce náchylný k mutacím.
U člověka uspořádána v kruhovitých nukleoidech, nemá metylaci cytosinu, nemá histony, odlišné zastoupení bazí.
Odchylky od univerzálního genetického kódu. Lehké komplementární vlákno (L; bohaté na cytosin) a těžké komplementární vlákno (H; bohaté na guanin), na kterém je většina genů.
Replikace mtDNA: náhodný proces, některé molekuly replikují častěji. Kontrola patrně celkovým obsahem mtDNA.
Tradiční model – vaflový/válečkový model – ve většině případů neplatí.
Mitochondriální retikulum – síť podléhající dynamické přestavbě. Oddělují se z ní menší části (fission, podobné odškrování klatrinových váčků, podíl dynamin related proteinů) a jiné části s ní zase splývají (fusion, fůzní proteiny). Mitochondriální retikulum navázané na cytoskelet, pomocí kynesinu a dyneinu je schopné se pohybovat.
Struktura mitochondrií uzpůsobena specializaci buňky – ve svalových buňkách natlačené mitochondrie mezi miyogfibrily, u spermií v krčku atd.
4 kompartmenty. Vnější membrána, mezimembránový prostor, vnitřní membrána, matrix. Vnější membrána je obecně propustnější mnež jiné membrány, volně propustná pro H+ ionty, v tomto ohledu se mezimembránový prostor rovná cytosolu. Ale není propustná pro proteiny. Vnitřní membrána obsahuje nejvíce proteinů ze všech membrán, je zřasena do krist → zvětšení povrchu, více prostoru pro OXPHOS a přenašeče. Některé kristy ústí široce do mezimembránového prostoru, jiné přichyceny jen úzkým kontaktem – připomíná to thylakoidy, které jsou oddělené úplně.
Stavba genomu. Mitochondrie obsahují velké množství kopií mtDNA. Mt Genom je vysoce násilný k mutacím – vystavení ROS z OXPHOS. Uspořádána v kruhovitých nukleoidech. Lehké komplementární vlákno (bohaté na cytosin) a těžké komplementární vlákno (bohaté na guanin). Člověk – 17kbp, 37 genů (28 na těžkém a 9 na lehkém vlákně). 13 genů pro proteiny oxphosu, 22 pro tRNA a 2 pro rRNA malé a velké podjednotky. U mnoha jednobuněčných organizmů mtDNA lineární, s telomerami nezávislými na telomeráze. U okurky – mitochondrie s třemi nezávislými kruhovitými „chromozomy“.
Hydrogenozómy. Jedná se o mitochondrie, které ztratily většinu enzymů, zbyly jim však hydrogenázy. Akceptorem elektronů je ferredoxin, a posléze protony, redukcí protonů vzniká plynný vodík – odtud název hydrogenozom. Jinak mají rovněž alternativní metabolismus popsaný níže v kapitole Funkce mitochondrií (s ASCT), a ferredoxin zde funhguje v pyruvát dehydrogenázové reakci místo NADH. Inhibitor reakce – redukce ferredoxinu – metronidazol – lék proti trichomonázám.
Mitozómy. Odvozené z mt, nemají mtDNA. Syntéza Fe-S komplexů.
cyklus kyseliny citrónové, cyklus trikarboxylových kyselin, Krebsův cyklus
Probíhá v matrix mitochondrií. Jeho funkcí je transformace energie.
Před začátkem cyklu se dekarboxyluje pyruvát a vznikne Acetyl-coA a NADH.
Enzymy dekarboxylují kyselinu citónovou a jiné enzymy ji také oxidují
Výsledek: 3 NADH+H+, 1 FADH2, 1 ATP
Do vzorku postupně přidávány dNTP, když se na sekvenci naváže ten správný, uvolní se 2 fosfáty – přeměněny ATP sulfurylásou na ATP – přechod s luciferinem na luciferázu – uvolní se světlo a oxyluciferin; když se naváže – zasvítí to.
Emulzní PCR replikuje DNA přichycenou na kuličku. Kuličky navalené do jamek na nějaké destičce.
Má problém s homopolymery.
Elektroforéza. Patří mezi separační metody izolující molekuly o rozdílné hmotnosti, popř. odlišném elektrickém náboji, využívající jejich odlišnou pohyblivost v elektrickém poli.
Centrifugace. Slouží k rozdělení částic pomocí odstředivé síly. Často jde o urychlení sedimentace. Zatímco při sedimentaci se částice rozdělují podle své hustoty vlivem gravitačního zrychlení, při centrifugaci na ně působí mnohem větší odstředivé zrychlení. Rozdělení směsi proto probíhá mnohem rychleji.
V nejjednodušších případech se centrifugace používá k oddělení pevných částic ze suspenze, např. k odstranění sraženin či krvinek z plné krve. Pomocí centrifugace je také možné rozdělit směsi nemísitelných kapalin. S využitím vysokých rychlostí, jichž se dosahuje ve vysokootáčkových centrifugách a ultracentrifugách, lze také separovat jednotlivé součásti buněk z buněčného lyzátu nebo rozdělit směsi makromolekul.
Chromatografie. Chromatografie jsou fyzikálně-chemické separační metody, jejichž podstatou je rozdělování složek směsi vzorku mezi dvě fáze, a to fázi nepohyblivou (stacionární fázi) a pohyblivou (mobilní fázi). Tyto dvě fáze se od sebe odlišují některou základní fyzikálně-chemickou vlastností, např. polaritou. Spolu s pohybující se mobilní fází je soustavou unášen také vzorek. Dělené složky vzorku (analyty) interagují v různé míře se stacionární a mobilní fází. Analyty, které se poutají více ke stacionární fázi, se pohybují pomaleji a jsou zadržovány déle, než analyty, které se ke stacionární fázi poutají méně. Na základě tohoto principu dochází k rozdělení složek směsi.
Genetika je nauka o genech.
Extrachromozomální genetické elementy, které se replikují nezávisle na chromozómu, obvykle se vyskytují u bakterií, archea, někdy i u eukaryot, obsahují různé doplňující genetické informace, uplatňují se při horizontální výměně g. informce – tzv. konjugaci. Kružnicová / lineární DNA, velikost 1 až >100 kbp, několik až několik tisíc / 1 buňka, 1 nebo několik genů, replikace řízena stejným aparátem jako replikace chromozómu, náhodná distribuce do dceřinných buněk, většinou nejsou zásadní pro život buňky.
Vertikální přenos dědičné informace. Z rodiče na potomka prostřednictvím pohlavního či nepohlavního rozmnožování.
Horizontální (laterální) přenos dědičné informace. Mezi nepříbuznými organismy. Je častý mezi bakteriemi (např. přenos rezistence proti bakteriím).
Semiautonomní organely – mitochondrie a plastidy – mají vlastní proteosyntetický aparát, ale mnoho složek je kódovano jadernou DNA. Změny v organelárních genomech během evoluce – počet genů, struktura genomu, variabilita nukleotidových sekvencí jednotlivých genů.
Chloroplasty a mitochondrie.
Vznikly endosymbiózou.
Původ mitochondrií. 2 miliardy YBP. Amitochondriální eukaryot/prokaryot (aerobní), příbuzný předkům dnešních α proteobakterií vstoupil do interakce s anaerobním prokaryotem a dal vzniknout první eukaryotické buňce s mitochondriemi (nebo vůbec první eukaryotické buňce). Obě membrány mitochondrií původu bakteriálního G- (i ve venější jsou poriny). Endosymbióza musela přinášet okamžité výhody jiné než OXPHOS, protože pro ten se musel vyvinout transportní systém do a z mitochondrií. Možnosti:
• Ox-Tox model: předek mitochondriesvým aerobním metabolsimem snižoval koncentraci kyslíku v okolí, což bylo výhodné pro anaerobního symbionta, pro kterého byl kyslík toxický.
• Parazitární model: předek mitochondrie pronikl do (anaerobního) eukaryota jako parazit, který nepřinášel hostiteliu výhodu, eukaryot invazi přežil a parazita si zotročil.
• Syntrofické modely: oboustranná výhodnná výměna metabolitů mezi symbionty.
Původ chloroplastů. 1,5 miliardy YBP. K primární endosymbióze (pohlcení sinice eukaryotem)došlo jednou → vznik plastidů – genom kulatý jako u sinic, stejné pořadí genů. Obě membrány chloroplastu jsou sinicového původu. Vznik tří linií – Glaucophyta, Rhodophyta, Chlorophyta. Sekundární endosymbióza –heterotrofní organismus pohltil organismus s primární endosymbiózou. Pokud tento patřil mezi chlorophyta → vznik euglenophyta, chlorarachniophyta (mořské améby). Pokud mezi rhodophyta → vznik chromist (rozsivky, Obrněnky, Apicomplexa). Sekundární endosymbiont má tři genomy (vlastní jaderný genom, jaderný genom ruduchy/zelené řasy – v nukleomorfu, sinice - plastidový). Některé obrněnky pak ještě provedli terciární endosymbiózu.
Paulinella chromatofora – prodělala primární endosymbiózu sinice Synechococcus recentně.
Tendence – laterální genový přenos (LGT)→genom organel se zmenšuje, geny přechází do jádra.
chemické sekvenování
Nutné radioaktivní značení na 5´konci fragmentu (P) – vzorek je specificky štípán na 5 částí různými látkami – tyto sekvence se umístí vedle sebe do polyakrylamidového gelu – elektroforéza – sekvence seřazeny podle délky – vyhodnotíme původní řazení.
enzymatická metoda, dideoxy
1977
Jako první se využívalo Sangerovo sekvenování k vytváření EST a cDNA, popsané na obrázku. EST (z expressed sequence tag) je krátké, needitované, náhodně vybrané čtení (100 – 1000 bp) odvozené z knihovny cDNA. Mezi nevýhody této metody patří její vysoká cena, potřeba velkého množství RNA, a obvykle není kvantitativní.
DNA je rozštípaná restrikčními enzymy. Vzniklé fragmenty jsou namnoženy pomocí PCR. Pomocí tepla je DNA denaturovaná. Na templát nasednou primery.
Směs rozdělíme do 4 zkumavek. Do každé z nich přidáme jiný fluorescenčně značený ddNTP (3' OH → H), DNA polymerázu a dNTP. Vzniknou řetězce různé délky.
Tyto řetězce se opět denaturují a rozdělí se pomocí polyakrylamidové elektroforézy. Uražená vzdálenost je úměrná délce fragmentů. Skombinováním proužků od spoda dostaneme sekvenci DNA.
single molecule real time sequencing
Značení dNTP na 5´konci, po přidání dalšího dNTP původní signál zhasne; sleduje v reálném čase replikaci
Typ Drosophila. XX samice, XY samec. Samec má SRY gen. Př. lidé a další savci.
Typ Abraxas. ZW samice, ZZ samec. Př. ptáci, motýli.
Poměr gonozomů k autozomům. XX samice, X0 samec. Nemá zvláštní pohlavní chromozom. Př. rovnokřídlí, šváby a další hmyz, někteří savci.
Haplodiploidní systém. Neoplozené (haploidní) vajíčko sameček, oplozené (diploidní) vajíčko samička (dělnice / královna). Př. včely, čmeláci.
Komplexnější systém polymorfních pohlavních chromozomů. Více než dva typy pohlavních chromozomů. Př. rostliny.
Většina jeho genetické informace se nerekombinuje. Vyskytuje se v permanentně haploidním stavu. Geny mají tendenci degenerovat během evoluce. Vyšší rychlost mutací, které jsou fixovány. Citlivější ke změnám v populaci. Tendence hromadit geny „prospěšné“ samčímu pohlaví. Variabilita mezi různými skupinami savců (X mnohem konzervativnější). Společný autozomální předek s X chromozomem.
Části Y chromozomu:
U člověka je jeden z X chromozomů ženy inaktivován a stává se z něj Barrovo tělísko.
Oxidativní fosforylace je proces, kdy je tvorba ATP z ADP spřažená s oxidací NADH nebo FADH2 a přenosem elektronů pomocí přenašečů. Dochází k tvorbě gradientu H+.
Proces se odehrává na vnitřní membráně mitochondrie.
Tutoriál od sciencemusicvideos
Nemendelistické štěpení, uniparentální dědičnost, neidentita reciprokých křížení, geny nelze namapovat k jaderným genům.
Obvykle matroklinita (95 %), výjimečně patroklinita, biparentální dědičnost (téměř 5 %). U biparentální dědičnosti je v zygotě samčí i samičí mimojaderná genetická informace.
Heteroplazmie. Pokud má buňka část mimojaderné DNA zmutovanou a část ne. Projev mutace záleží na podílu mutantní DNA.
Sekvenován přímo templát skrze kanál na membráně a motorový protein (mění se proud v kanálu) – podle velikosti změny potenciálu se pozná, jaká báze kanálem prochází.
Hydrogenozom je organela některých anaerobních nálevníků, trichomonád či hub. Produkuje molekulární vodík (odtud jméno).
Známé jsou hydrogenozomy především u parazitů Trichomonas vaginalis a Tritrichomonas foetus, ale též u houbových chytridiomycet rodu Neocallimastix.
Funkčně podobné mitochondriím: dvojitá membrána, produkce ATP. Na rozdíl od nich nemají DNA a fungují i v anaerobním prostředí.
Heritabilita (koeficient dědivosti) udává, jak velká část proměnlivosti vzniku znaku je zapříčiněná geny / vnějšími faktory.
Genotyp je soubor veškeré genetické informace daného jedince (jakou konkrétní sestavu alel má) týkající se sledovaných znaků.
Genofond je soubor všech alel populace v daném čase a místě.
Fenotyp je soubor všech pozorovatelných vlastností a znaků živého organismu.
Karyotyp je soubor chromozomů jedince.
Multialelismus = polymorfní geny (více druhů alel než 2)
Expresivita je stupeň projevu znaku. Liší se mezi různými fenotypy. Variabilní / konstantní expresivita.
Obor genetiky zabývající se studiem genomu organismů. Spadá sem získávání sekvencí DNA organismů + genové mapování + anotace genů.
Většinou kružnicová dsDNA (někdy i lineární DNA), obvykle jedna hlavní molekula = bakteriální chromozom a plazmidy (cirkulární nebo lineární DNA).)
Replikace mitochondriální DNA: náhodný proces, některé molekuly replikují častěji, kontrola patrně celkovým obsahem mtDNA. Proteosyntéza – lidská mitochondrie má 22 genů pro tRNA a 2 geny pro rRNA malé a velké podjednotky, má vlastní transkripční a translační aparát, částečně kódovaný v mitochondriích.
Replikace ctDNA: nezávisí na replikaci jaderné DNA, proteiny nutné pro replikaci mají jaderný původ, počet kopií ctDNA kolísá, má 2 počátky replikace. ctDNA částečně kóduje vlastní proteosyntetický aparát – 4 rRNA, 21 ribozomálních proteinů, 30 – 37 tRNA (wobbling) a vlastní RNA polymerázu.
Pohlavně vázané znaky. Znaky determinované geny, které jsou lokalizovány na pohlavních chromozomech. Př. hemofilie A a B u člověka (gonozomálně recesivní), jedna z forem barvosleposti (recesivní, na X), porucha vnímání zelené (deuteranopie) a červené (protanopie) barvy.
Pohlavně ovládané znaky. Znaky determinované geny, které jsou lokalizované na autozomech, ale jejich exprese závisí na pohlaví jedince. A to buď zcela, nebo se různě vyjadřuje v závislosti na pohlaví (např. sekundární pohlavní znaky). Př. familiární testotoxikóza u člověka (autozomálně dominantní choroba projevující se pouze u chlapců).
Pohlavně ovlivněné znaky. Znaky determinované geny, které jsou lokalizovány na autozomec. Projevují se u obou pohlaví, ale mezi pohlavími se liší buď frekvence projevu nebo vztah mezi genotypem a fenotypem (u jednoho pohlaví se projevují jako dominantní, u druhého jako recesivní). Př. pohlavně ovlivněná plešatost u člověka (muži recesivní, ženy dominantní)
Principy základních metod molekulární biologie
Human genome project. Cíle: identifikovat a zmapovat všechny lidské geny, konstrukce detailní fyzické mapy celého genomu, určení sekvence všech lidských chromozómů. Mezinárodní spoluúčast (VB, Japonsko, Německo, Francie, Čína) → projekt HUGO (Human Genome Organization) Historie HGP
Projekt lidského genomu, začal 1990.
1995 mapa DNA markerů vzdálených cca 500 kb
1996 detailní mapa mikrosatelitních marker
1997 zamapování 16354 lokusů, RH mapa s 10478 STS markery
2001 publikace draftu (1. verze) sekvence lidského genomu
2001 více jak 2650 Mbp sekvenováno (92/95
2004 341mezer, 99
2006 publikace poslední sekvence posledního chromozómu (problémy s centromerickými a telomerickými oblastmi → několik mezer) Další sekvenční projekty
The 1000 genomes project – sekvence lidských genomů z různých částí světa
ENCODE – identifikace funkce všech negenových funkčních segmentů
HUPO – určení struktury a funkce všech proteinů – produktů genů Salting-in, salting-out Přidávám li sůl do rozpouštědla, nejdříve rozpustnost proteinu roste, posléze začne klesat a protein se vysráží. Různé proteiny se vysráží postupně. DNA se vysráží přidáním etanolu.
Polovodičové pH sekvenování; odečtení pH hodnoty po navázání správného nukleotidu.
Genom je úplný soubor veškeré genetické informace organismu. Celková sekvence nukleové kyseliny mající informační hodnotu
Velikost, organizace a struktura genomu se liší mezi buňkami jedince, mezi jedinci, populacem, druhy. Změny v čase (během buněčného cyklu, během vývoje jedince).
Stavba buňky
Membrány
Dynamika a funkce buněčných kompartmentů
Funkční anatomie buněčného jádra
Semiautonomní organely
Cytoskelet
Mezibuněčné spoje a mezibuněčná hmota
Buněčný cyklus a programovaná buněčná smrt
Komunikace uvnitř buněk a mezi buňkami
c-hodnota je celkový obsah DNA v haploidním genomu.
Neexistuje přímá korelace mezi velikostí genomu a biologickou komplexitou organismu. Stanovení c-hodnoty může být zkresleno polyploidií, experimentální chybou, repetitivní sekvencí.
polyakrylamidový gel (DNA), nebo agarózový (proteiny)
dvě elektrody
vzorek se napipetuje do jamek
potřebujeme standard na srovnání
proužky vyniknou pod UV světlem
využívá se nějaká barvička
DNA putuje ke kladné elektrodě, protože má záporně nabité fosfáty.
Jak daleko se molekuly dostanou záleží na jejich velikosti a náboji.
Rozpad jaderného laminu v profázi. Laminy fosforylovány pomocí MPF – síť se rozpadne a s ní i jádro. 3 jaderné laminy A, B, C. Laminy se zpět repolymerují v telofázi.
Cytokineze je rozdělení cytoplazmy na 2 části. Začíná v anafázi.
U živočichů se tvoří přechodová struktura zvaná kontraktilní prstenec z aktinových a myozinových filament. Rovina buněčného dělení je určena mitotickým vřeténkem (symetrické dělení, když je uprostřed; asymetrické u embryonálního vývoje).
U rostlin řídí cytokinezi fragmoplast, což je útvar z mikrotubulů v ekvatoriální rovině, a syntetizuje se nová buněčná stěna.
Znak je vlastnost organismu, kterou můžeme pozorovat. Musí se vyskytovat minimálně ve 2 alternativách. Vzniká expresí genů.
Gen je základní jednotka dědičnosti předávaná z generace na generaci. S vymezením pojmu gen jsou problémy.
1gen → 1 fenotypový znak.
1 mutantní gen → 1 přerušení metabolické dráhy.
1 gen → 1 enzym.
1 gen → 1 protein.
1 gen → 1 polypeptid. Ale gen nemusí kódovat jen polypeptid.
Nyní gen to, co přepisováno do RNA (nemusí být translatováno). Geny pro RNA – pro rRNA, tRNA, snRNA, snoRNA a další nejsou určeny k transalci. Regulační“ geny – miRNA, siRNA... dávají například pokyn k zahájení nebo zastavení transkripce, nejsou určeny k translaci.
Gen je základní jednotka dědičnosti předávaná z generace na generaci. S vymezením pojmu gen jsou problémy.
Pojetí genu se od znovuobjevení Mendelovy práce v roce 1900 mnohokrát upřesňovalo. On tvrdil, že 1gen → 1 fenotypový znak.
A. E. Garrod – 1902 výzkum alkaptonurie u člověka = vrozená metabolická porucha; propojení dědičnosti s metabolizmem, spojení mezi genetikou a biochemií. Uvedl hypotézu 1 mutantní gen → 1 přerušení metabolické dráhy.
Až v roce 1941 prokázali G. Beadle a E. Tatum, že geny kódují enzymy, katalyzující biochemické reakce. Jejich objevem začala éra biochemické genetiky. Došli k závěru, že pro každou enzymaticky kontroovanou reakci existuje monogenně dědičná mutace → hypotéza 1 gen → 1 enzym.
Pauling a kolegové – 1949 studium srpkovité anémie (hemoglobiny se liší svými chemickými vlastnostmi – HbA, HbS) → hypotéza 1 gen → 1 protein.
Ingram – 1954 – hypotéza 1 gen → 1 polypeptid. Ale gen nemusí kódovat jen polypeptid.
Nyní gen to, co přepisováno do RNA (nemusí být translatováno). Geny pro RNA – pro rRNA, tRNA, snRNA, snoRNA a další nejsou určeny k transalci. Regulační“ geny – miRNA, siRNA... dávají například pokyn k zahájení nebo zastavení transkripce, nejsou určeny k translaci.
Zpracování genetické informace.
Základy genetiky
Mutace a mutageneze
Exprese genů a její regulace
Cyklus, kterým buňka prochází od svého vzniku až po další dělení.
Nejjednodušší dělení u bakterií. Binární dělení – mateřská buňka se dělí na 2 dceřinné. FtsZ je homolog tubulinu.
Složitá síť organel. Rozlišujeme mitózu (dělení somatických buněk) a meiózu (dělení pohlavních buněk).
Buněčný cyklus je posloupnost událostí, během kterých buňka zvojnásobí svůj obsah a rozdělí se na dvě buňky.
Nejzákladnější funkcí buněčného cyklu je přesná duplikace DNA v chromozomech a následné rozdělení DNA do geneticky indentických dceřiných buněk, každá z nich bude mít kompletní kopii celého genomu.
Ve většině případů se duplikují ostatní makromolekuly a organely a zdvojnásobí se velikost. (Výjimkou je například žabí embryo v raném stádiu.)
M fáze. Dělení jádra = mitóza a dělení buňky = cytokineze.
G1 fáze. Mezi M a S fází. Růst. Při nedostatku živin přechod do G0 fáze.
S fáze. Replikace jaderné DNA a syntéza proteinů.
G2 fáze. Mezi S a M. Příprava na M fázi. Buňka hromadí enzymy. Kondenzace chromozomů na konci.
Kontrolní body cyklu. G1 (kontrola fyziologických vlastností a DNA), S (kontrola poškození DNA a syntézy), G2 (podmínky pro přechod do M), M (spidle assembly checkpoint – správně napojené mitotické vřeténko).
Alely jsou různé formy téhož genu umístěné na stejném lokusu homologních chromozomů.
Dominantní alela je taková alela (varianta určitého genu), která při kombinaci s příslušnou recesivní alelou toho samého genu „převládne“ a určí fenotyp daného jedince. Dominance může být úplná nebo částečná. To znamená, že při částečné dominanci sice dominantní alela převáží, ale i recesivní alela se může částečně uplatnit.
Sestává se z genetické informace v jádře, mitochondriích, plastidech a plazmidech.
Mitochondriální a plastidový genom: kružnicové molekuly dsDNA, lineární molekuly, různě větvené molekuly. V plastidech získaných sekundární či terciární endosymbiózou navíc nukleomorf - zbytek jádra původního organismu po sekundární endosymbióze.
Jaderný genom: lineární dsDNA segmentovaná na jednotlivé chromozómy. Menší genová hustota než u prokaryot. Podstatně více DNA než mají prokaryota. Variabilita ve velikosti genomu.
Homozygot je diploidní organismus, který nese 2 stejné alely téhož genu.
Heterozygot je diploidní organismus, který nese 2 různé alely téhož genu.
Složení živých buněk
Energetický metabolismus
Struktury proteinů
Struktura nukleových kyselin
Enzymy a jejich vlastnosti
Evoluce
Mechanismy evoluce 🙈
Mutace jako zdroj evolučních novinek
Selekce 🙈
Pohlavní výběr 🙈
Speciace 🙈
Evoluce pohlavního rozmnožování
Homologie
Jadérko (nukleolus) – asemblace ribozómů. Obsahuje jaderný organizátor – tandemové repetice rDNA kódující rRNA. RNA polymeráza I – přepisuje rDNA na transkript, který posléze rozštěpen na jednotlivé rRNA. Asemblaci ribozómu umožňuje small nucleolar RNA (snoRNA). Transkripce rRNA a asemblace ribozómu v jadérku prostorově oddělené.
Průchod BC regulují cyklin dependentní kinázy (Cdk; nutná asociace s cyklinem). Cdk asociuje s cykliny a určuje, které substráty budou fosforylovány.
G1 Cdk → inaktivace APC = anaphase promoting complex; příprava na S fázi; stimulace buňky k replikaci
S Cdk → aktivace prereplikačního komplexu iniciujícího replikaci
Mit Cdk → MPF = mitose promoting factor; indukuje kondenzaci chromozomů; rozpad jaderného obalu; organizace dělícího vřeténka; aktivuje APC, který řídí v pozdní anafázi proteolytickou degradaci mitotických cyklinů
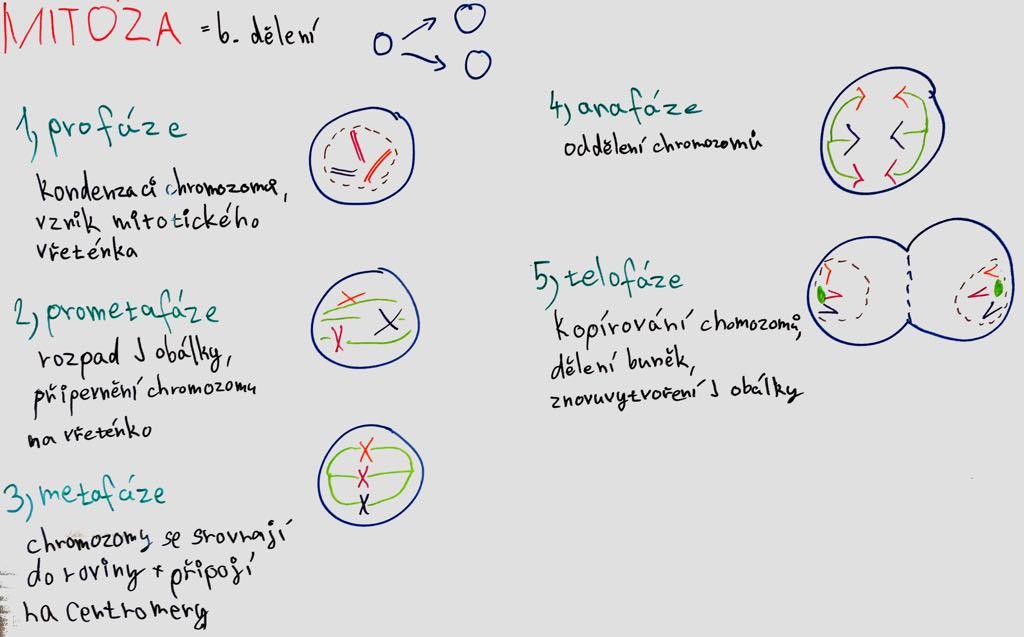
kondenzace chromozomů, centrioly se pohybují ke krajům buňky, vznik mitotického vřeténka
Během profáze dochází ke kondenzaci chomozomů. Každý z chromozomů se skládá ze dvou sesterských chromatid. Dále se v cytoplasmě vytváří mezi dvěma centromerami mitotické vřeténko. Centromery se začínají pohybovat směrem od sebe.

rozpad jaderné obálky, připevnění chromozomů na vřeténko
V prometafázi se rozpadá jaderná obálka. Následně se mohou chromozomy připevnit pomocí kinetochorů na mikrotubuly vřeténka. Dále se chromozomy dávají do pohybu.
DNA (chromozomy) se zarovnává na osu a připojuje se na centromery.
ekvatoriální rovina
Chromozomy se vyrovnají na ekvatoriální rovině vřeténka a vytvoří metafázickou desku. Mikrotubuly kinetochoru každé ze sesterských chromatid jsou upevněné na opačné póly vřeténka.
segregace chromozomů
V průběhu anafáze se sesterské chromatidy synchronizovaně rozcházejí a pomalu se pohybují k pólům, ke kterým jsou připevněné. Zkracují se mikrotubuly kinetochorů a póly se pohybují směrem k okrajům buňky.
Chromozomy se kopírují, buňka se dělí.
znovuvytvoření jaderné obálky
Během telofáze se u každého z pólů nachází jedna sada chromozomů. Okolo každé sady chromozomů se obnoví jaderná obálka. Dokončí se vytvoření dvou jader a začne dělení cytoplasmy (v případě živočichů se vytvoří kontraktilní prstenec).
Repetitivní sekvence: strukturní a organizační úloha v chromozómu, účast a párování chromozómů při meióze, účast na CO při rekombinaci, ochrana důležitých genů, sklad nedůležitých sekvencí (evoluční význam), tzv. junk DNA – sekvence bez zjevného významu.
Více než 50% lidského genomu tvoří repetitivní sekvence (45% transponovatelné elementy – aktivní/inaktivní, 5% segmentální duplikace – velké celky genomu, 3% SSR). Zbylá část je tvořena 25% geny (1,2% exony, 24% introny), 22% mezigenová DNA.
Strukturní geny jsou delší než u prokaryot. Jsou složené z exonů a intronů. Introny (intervening sequences) jsou nekódující sekvence vmezeřené mezi kódující sekvence v rámci jednoho genu. Exony (expressed sequences) jsou sekvence kódující protein.
Esenciální geny: kódují funkce nutné pro život organismu. Procento esenciálních genů klesá s velikostí genomu.
Provozní geny: houskeeping, transkripce ve všech buňkách, zajištění fce. buněk, patří mezi esenciální, např. geny pro tRNA, rRNA, ribozomální proteiny, polymerasy, některé enzymy aj.
Pseudogeny = nefunkční geny. Sekvenční homologie se známými geny.
Homologní rekombinace. Zahájená štěpením 1 řetězce. Odvíjí se a včleňuje do druhé molekuly. U vytěsného vlákna zlom a překřížení. Vlákno se páruje s komplementárním řetězcem druhé molekuly. Přerušení jsou spojena. Vznik Hollidayovy struktury. Řetězce migrují a dojde buď k rotaci a štěpení a spojení/se štěpí všechny 4 řetězce a následně jsou spojeny; u E. Coli; RecA se váže na ssDNA a urychluje reakci mezi dvoušroubovicí a homologním úsekem ssDNA.
Crossing-over. Proces výměny genetické informace mezi 2 homologními chromozomy pro zvýšení variability.
Nehomologní rekombinace. V oblastech bez zřejmé homologie sekvencí DNA.
Místně specifická rekombinace. Prokaryota. Mezi specifickými páry sekvencí mezi nepříbuznými molekulami DNA.
Replikativní rekombinace. Inzerce sekvence DNA do jiné molekuly na základě vzniku nové kopie DNA sekvence.
Skupina genů nacházejících se na jednom chromozomu je tzv. genová vazebná skupina. Nemohou se volně kombinovat, jsou na sebe vázané. Ne všechny geny na jednom chromozomu jsou ve vazbě! Neplatí 3. Mendelův zákon o volné kombinovatelnosti alel.
Úplná genová vazba. Vůbec nedochází ke crossing-overu a celá skupina genů se při křížení jedinců chová jako jeden gen.
Neúplná genová vazba. Alely umístěné na jednom chromozomu se při úplné vazbě dědí společně, při částečné vazbě častěji společně než nezávisle.
Síla vazby. Mezi dvěma vzdálenými loky je vyšší pravděpodobnost crossing-overu (vazba je slabší) než u blízkých loků (silnější vazba).
alelické
Interakce alel v rámci jednoho genu (od každého genu máme 2 alely).
Kodominance. Rovnocenný projev obou dominantních alel. Neovlivňují se. Každá se projevuje nezávisle na druhé. Př. krevní skupiny.
Neúplná dominance. Jedna dominantní alela neposkytuje dostatek produktu pro vyjádření dominantního fenotypu. Př. heterozygot má růžový květ, dominantní homozygot červený.
Cyklus, kterým buňka prochází od svého vzniku až po další dělení
Nejjednodušší dělení u bakterií. Binární dělení – mateřská buňka se dělí na 2 dceřiné. FtsZ je homolog tubulinu.
Složitá síť organel. Rozlišujeme mitózu (dělení somatických buněk) a meiózu (dělení pohlavních buněk).
Buněčný cyklus je posloupnost událostí, během kterých buňka zvojnásobí svůj obsah a rozdělí se na dvě buňky. Obvykle má čtyři fáze: G1 fáze, S fáze, G2 fáze, M fáze.
Nejzákladnější funkcí buněčného cyklu je přesná duplikace DNA v chromozomech a následné rozdělení DNA do geneticky indentických dceřiných buněk, každá z nich bude mít kompletní kopii celého genomu.
Ve většině případů se duplikují ostatní makromolekuly a organely a zdvojnásobí se velikost. (Výjimkou je například žabí embryo v raném stádiu.)
M fáze. Dělení jádra = mitóza a dělení buňky = cytokineze.
G1 fáze. Mezi M a S fází. Růst. Při nedostatku živin přechod do G0 fáze.
S fáze. Replikace jaderné DNA a syntéza proteinů.
G2 fáze. Mezi S a M fází. Příprava na M fázi. Buňka hromadí enzymy. Kondenzace chromozomů na konci.
Kontrolní body cyklu. G1 (kontrola fyziologických vlastností a DNA), S (kontrola poškození DNA a syntézy), G2 (podmínky pro přechod do M), M (spindle assembly checkpoint – správně napojené mitotické vřeténko).
nealelické
Interakce mezi alelami alespoň 2 různých genů.
Reciprocita. Dva geny se ovlivňují a spolupodílí na vzniku znaku. Nenastává však změna fenotypového poměru.
Duplicita (multiplicita).
Epistáze.
Komplementarita. Znak se projeví pouze spolupůsobením dominantních alel obou interagujících genů. Př. zbarvení květů u hrachoru.
Inhibice. Dominantní alela jednoho genu potlačuje dominantní projev alely jiného genu. Sama ale projev nemá.
DNA – 4 báze A,C,T,G, párování A-T,C-G, triplet – jedna aminokyselina.
U bakterií v bakteriálním „chromozomu“ – kruhovitá DNA, jeden origin, a asociované proteiny, neoddělené v jádře. Plazmidy – malá kruhovitá DNA. Archea – struktury podobnější chromozomům eukaryot. Eukaryota mají chromozómy, a dále plastidovou a mitochondriální DNA. Supercoiling – DNA prokaryot i eukaryot je vinutá na více úrovních, pro replikaci a transkripci je třeba ji rozvinout.
Heterochromatin – transkripce neprobíhá, euchromatin – transkripce probíhá. Euchromatin lokalizován spíše uvnitř jádra, zatímco heterochromatin na okraji. Ale výjimky. V tyčinkách (zejména nočních savců) je tomu naopak, aby nedocházelo k rozptylu světla.
Funkce chromatinu: pakování DNA do malého objemu, zpevnění DNA pro mitózu, prevence poškození DNA, regulace exprese a replikace DNA.
Organizace chromatinu. DNA se otáčí kolem nukleozomů, této struktuře odpovídá euchromatin. Nukleozómy vznikají ze dvou histonů H3, dvou H4, dvou H2A a dvou H2B. Nukelozomy se pomocí H1 spojovacího (linker) histonu seskupují do 30nm vláken – heterochromatin. 30nm vlákna se dále pakují do vyšších úrovní během kondenzace chromozómu v profázi meiózy/mitózy.
Histony mohou být modifikovány – acetylace pomocí enzymů HAT (Histon acetyl transferase), a deacetylace HDAC (histon deacetylase). Acetylace vede k rozvolnění konformace a uvolnění DNA pro transkripci. Metylace (lysinů, argininů) vede k zaujetí méně relaxované konformace, brání transkripci a přístupu proteinů k DNA. Dále fosforylace – funkce neznámá.
polymerázová řetězová reakce, anglicky Polymerase Chain Reaction
Polymerázová řetězová reakce je metoda rychlého a snadného zmnožení úseku DNA založená na principu replikace nukleových kyselin. Úseky DNA, které se mají namnožit (amplifikovat), musí být ohraničeny na začátku a na konci tzv. primery (krátkými oligonukleotidy DNA). PCR slouží k vytvoření až mnoha milionů exaktních kopií vzorového fragmentu DNA o maximální délce 10 tisíc nukleotidů (v některých případech bylo dosaženo délky až 40 tisíc), což umožňuje provést analýzu DNA i z velmi malého vzorku. K syntéze nového vlákna DNA se používá nejčastěji termostabilní DNA polymeráza bakterie Thermus aquaticus, odtud označení Taq polymeráza. PCR probíhá v zařízení zvaném termocykler, které je zkonstruováno tak, aby dokázalo během několika sekund zvýšit nebo snížit teplotu o několik desítek stupňů Celsia.
Mutace protoonkogenů vedoucí k jejich trvalé aktivitě. Mutace tumor supresorových genů (antionkogenů) vedoucí k jejich trvalé inaktivitě.
Benigní nádory – obalené pochvou a nemetastázují. Maligní metastázují. Nádory v důsledku mutace, obvykle více mutací s rostoucím věkem, kdy selhávají opravné mechanismy, kumuluje se poškození dané ROSy atd. Mutace daná spojením chromozomů, které spojené být neměly (chromozómy 9 a 22). Inzerce superonkogenu z virového genomu. Dlouhodobá aktivace Src tyrosin kinázy.
Tumor supresorové geny a proteiny (antionkogeny): p53 DNA vazebnou doménou detekuje poškození DNA → spustí expresi p21 →ten inhibuje cdkc komplexy→ apoptóza. 40% nádorů důsledek mutace v p53.
Genová exprese je proces, kdy je informace z genu využitá k syntéze funkčího produktu genu. Těmito produkty jsou často proteiny, nebo v případě genů nekódujících protein funkční RNA.
Struktury, do nichž je uspořádána jaderná DNA eukaryot.
Soubor chromozomů – chromozomová sada – karyotyp.
Polyploidie – organismus má více homologů každého chromozómu. Pohlavní chromozómy a autozómy.
Chromozomální určení pohlaví
Lyonizace: U člověka je jeden z X chromozomů ženy inaktivován a stává se z něj Barrovo tělísko. Nevíme, který to v dané buňce bude (k inaktivaci dochází až později během embryonálního vývoje), žena je tedy mozaika.
loss of heterozygosity (LOH)
Mutace alely určitého genu v somatické buňce, která již nese na homologickém chromozómu mutovanou alelu téhož genu.
Chaperony (=HSP – heat shock proteins) – zejména v ER, katalyzují sbalení proteinu do biologicky aktivní konformace, obvykle rozpoznávasjí částečně sbalené proteiny, naváží se na hydrofobní části proteinu a dají mu čas, aby se zbalil. Jiné chaperony mohou udržovat protein rozbalený pro transport do mitochondrie, kde se jej chaperony pustí a jiné na něj nasednou a zbalí jej.
Chaperonin HSP 60 uzavírá protein do soudečku i s jeho hydrofobními sekvencemi, kde se protein sbalí.
Jádro vzniklo invaginací buněčné membrány. Ta obalila genetickou informaci, a odvozováním z ní pak vznikali další kompartmenty.
nukleolemma, karyotéka
vnější jaderná membrána, propojená s membránou endoplasmatického retikula, a vnitřní membrána, mezi nimi perinukleární prostor, který má kontinuitu s lumen ER
komplex mnoha proteinů, asi 30 různých nukleoporinů, schopný přenést i ribozóm
Do cytoplazmy ční cytoplazmatická filamenta, která pomáhají vázat přenášené proteiny, do jádra zase intranukleární filamenta. Cytoplazmatická filamenta jsou navázána na cytoplazmatický kruh, následuje centrální kruh s lumenální doménou, a poté nukleární kruh, košík, vzdálený kruh (distal ring) a intranukleární filamenta. Vnitřní část póru vyplněna neuspořádanou gelovitou strukturou s obsahem FG repeats střídaných 30 amk dlouhými hydrofilními spacery (toto jsou tedy FG nukleoporiny), toto zabraňuje volné difůzi větších molekul.
Proteiny musí být do jádra transportovány pomocí přenašečů.
cytoskeleton v jádře
Jaderná lamina jsou střední filamenta podpírající vnitřní jadernou membránu. Podpora jaderných pórů a ukotvení chromozomů. Lamin B je univerzálně přítomný, laminy A a C (vznikají alternativním sestřihem z jedné hnRNA) chybí v některých embryonálních buňkách. Jaderná lamina se během profáze rozpadá, poté co MPF (mitosis promoting factor, komplex Cyclinu B a Cdk) spolu s PKC fosforyluje laminy na N koncové části →to vede k rozpadu laminové struktury na coiled coil dimery. Tyto jsou v anafázi recyklovány.
Pokud se lamin neskládá správně – laminopatie – příklad: progerie, dále různé mutace v laminu A a LBR vedou k muskulárním dystrofiím, kardiomyopatii ad.
Vnější jadernou membránu propojuje s cytosolickým aktinem a intermediárními filamenty skupina proteinů zvaná nespriny. Vnitřní membrána obsahuje integrální membránové proteiny emeriny, které váží nukleoplazmatický aktin, případně také centrozómy prostřednictvím mikrotubulů.
GABA. Dekarboxylace kyseliny glutamové na cystein.
Histamin. Dekarboxylace histidinu.
Dopamin. Dekarboxylace tyrosinu a jeho hydroxylace hned vedle již existující hydroxyskupiny.
Změna exprese, NE produktu; down mutace → snížení transkripce + zvětšení vzdálenosti od START nukleotidu; up mutace → zvýšení transkripce; zmenšení vzdálenosti od START nukleotidu.
Klonování DNA (též molekulární klonování) je laboratorní metoda spočívající v namnožení určitého úseku DNA za pomoci enzymatických systémů živých buněk. Je to několikafázový proces, který zahrnuje tři základní kroky:
4-hydroxyprolin.
5-hydroxylysin. Výskyt zejména ve strukturních proteinech – kolagen, keratin.
Mono, di, trimetylace na lysinu. Signální funkce.
N-acetylace na lysinu na histonech. I změna náboje, rozvolnění chromatinu.
Metylace argininu.
Fosforylace serinu, threoninu, tyrosinu. Signalizace.
Netýkají se DNA; většinou při transkripci; projev obvykle slábne s časem.
Mutace v 3´sestřihovém místě → sestřihový aparát toto místo přeskočí a dojde k odstranění exonu z transkriptu
Mutace v 5´sestřihovém místě → zachován intron v transkriptu
semikonzervativní = nová molekula z 1 starého a 1 nového vlákna; obě řetězce jsou komplementární a mohou sloužit jako templát.
replikační aparát = soubor proteinů pro replikaci;
replikační počátky = ori = místa, kde se dvoušrobovice poruší první (tato místa jsou rozpoznána iniciačními proteiny; bohaté na AT; u bakterií je genom kruhový a tedy 1 počátek);
replikační vidlička = začátky replikace ve tvaru Y, kam se vážou proteiny repl. aparátu (pohyb ve směru replikace a rozvíjejí šroubovici za syntézy nového vlákna; v 1 ori se tvoří dvě a pohybují se od sebe);
DNA polymeráza = enzym katalyzující polymeraci řetězce DNA – vkládá deoxyribonukleotidy a prodlužuje řetězec (tvar ruky; palm doména kontroluje párování; finger doména uzavře dNTP v katalytickém místě; thumb doména drží syntetizovanou DNA; katalyzuje připojení nukleotidů na 3´konec; v aktivním místě jsou Mg ionty; NTP dodává energii; má opravnou funkci = proofreading – před přidáním nukleotidu kontroluje předchozí pár); syntéza ve směru 5´- 3´; vedoucí řetězec = leading strand (syntéza kontinuálně) X opožďující = lagging strand (diskontinuálně;
Okazakiho fragmenty = primery – nukleáza odstraní RNA primery, DNA Pol je nahradí DNA a ligáza spojí));
primery = krátké úseky RNA (DNA POL neumí začít syntézu sama; tvorba primázou);
helikáza = rozvíjí ATP za spotřeby ATP; SSB proteiny = ochraňují 1vláknovou DNA před spojením;
sliding clamp proteiny = svorkové (vážou DNA POL na templát); replisom (komplex proteinů podílejícíh se na replikaci v místě vidličky)
Telomeráza u eukaryot. Při ukončení replikace není možné doplnit poslední nukleázou odstraněné RNA primery; telomerasa nepotřebuje templát a funguje mechanismem reverzní transkriptázy; nasedá na 3' přesah a prodlouží konec; řeší problémy konců telomer a brání jejich zkracování při replikaci.
kruhová molekula DNA; 1 ORI;
a) replikační vidlice oběma směry a nasedá na DnaA protein – DnaB helikáza rozvolňuje šroubovici – primáza nasyntetizuje primer – DNA POL III prodlužuje řetězec; primozom = komplex helikázy a primázy se pohybuje kolem DNA; DNA POL III prodlužuje primery – DNA POL I vymění RNA za DNA – ligáza je spojí; terminace replikace v terA a terB;
b) valivá kružnice; jednovláknové přerušení kružnicové molekuly – replikuje se druhé neporušené vlákno – vznik produktu, kde jsou za sebou umístěny kopie plazmidu – rozstříháno na správnou velikost a zaligováno
Kanibalistická teorie. Jeden organismus sežral druhý organismus stejného druhu. Dostala se mu dovnitř cizí DNA. Vyvinula se mitóza. Diploidní organismy jsou odolnější. Zařadili cizí DNA do své.
Teorie promiskuitních bublin. Předbuněčné stádium. Silný horizontální genový přesun. Vyměňování genetických informací. Jejich zařazení. Meióza...
Teorie vzniku odolných diploidních stádií. Shlukování protoeukaryot za nepříznivých podmínek – možnost splývání.
Ve stejném místě jako byla mutace přímá.
Pravá reverze. Obnova mutované skevence nukleotidů na původní. Opačná reverze – změna kodonu na kodon synonymní k původnímu kodónu (před pímou mutací).
Částečná reverze. Změna kodónu na nesynonymní kodón, leč takový, že dojde k úplné či častečné obnově funkce s novou AK oproti mutaci přímé.
Vliv na expresi jednoho sousedního genu; geny lokalizovány na jedné straně mutantního genu.
Mutace v genu, který kóduje produkt účastnící se regulace transkripce jiného genu/mutace v regulační oblasti genu.
Analogy bází se začleňují do DNA během replikace.
Př. 5-bromuracil (analog T), 2-aminopurin (analog A).
Hydroxylační látky např. hydroxylamin mění cytosin na hydroxylamincytosin.
Interkalační látky se vmezeřují nebo zakliňují do DNA, čímž způsobují posunové mutace.
Př: ethidiumbromid, akridinová oranž, proflavin.
ROS (reactive oxygen species) jsou reaktivní formy kyslíku, které poškozují DNA, lipidy i proteiny. K jejich produkci dochází v mitochondriích. Asi 2-3 % kyslíku v mitochondriích jsou redukovány na ROS.
Odstraňují se pomocí superoxid dismutázy (superoxidový radikál → H2O2), katalázy (H2O2 → H2O), glutathion peroxidázy.
Neexistuje vždy korelace mezi rychlostí metabolismu a délkou života (rychlejší metabolismus…– kratší život). Existuje celá řada výjimek jako ptáci, vačnatci, netopýří… Ač je tělo rypoše vystaveno velké míře oxidativního stresu, dožívá se v zajetí 28 let. Tedy musí mít jiné mechanismy.
Př.: peroxidy, superoxidy, hydroxylový radikál, singletový kyslík.
Alkylační látky přidají alkylovou skupinu, čímž způsobují substituce (tranverze a tranzice) a chromozomové aberace.
Př. EMS, MMS ⇒ alkylace G v poloze 6 ⇒ párování s T ⇒ změna GC na AT
Kyselina dusitá nahrazuje amino skupinu keto skupinou, tomuto procesu se říká oxidativní deaminace. Působí na A, C, G.
Selektivní transport mRNA do cytoplasmy.
Translace regulována také přes vazbu proteinů na 3D struktury v rámci 5’UTR a 3’UTR.
Modifikace postranních řetězců aminokyselin ještě když jsou navázány na aminoacyl-tRNA – jedná se o pre-translační/kotranslační modifikaci.
Rozeznáváme 20 základních aminokyselin tvořících proteiny. Existují 2 zvláštní aminokyseliny nevznikající posttranslační modifikací:
Při pH = 7 tvoří všechn mlk volné aminokyseliny zwitterion.
Zwitterion je molekula, která obsahuje kladný i záporný náboj v různých částech molekula, ale je celkově neutrální.
Atomy Cα všech aminokyselin kromě glycinu mají čtyři substituenty.
Peptidová vazba je vazba mezi dvěma molekulami aminokyselin. Váže se aminová skupina z jedné molekuly s karboxylovou skupinou z druhé molekuly.
Vazba mezi O=C a N-H má částečně dvojný charakter, proto nemůže volně rotovat.
Konfigurace cis se vyskytuje v 10 % vazeb v prolinu, protože je výhodnější. Jinak obecně je konfigurace cis méně energeticky výhodná.
V užším smyslu – nepříznivé podmínky na Zemi – důležitost oprav DNA – odstraňování mutací – když je jen jedna verze DNA jako předloha, vždy se bude chyba kopírovat – je nutné mít dvě, aby mohla být špatná sekvence opravena.
Reset epigenetických signálů a oprava ploidie. Není nejdůležitější rozdělit se, ale opravit se.
Dochází k omezení nežádoucí variability.
Somatické buňky jsou schopny dovršit pouze určitý, předem daný počet buněčných dělení.
Lidské fibroblasty – 50-60 mitóz
Vyjímku tvoří maligně transformované buňky.
Zygota tak má před sebou pouze omezený počet mitóz a pouze linie zárodečných buněk, které opakovaně procházejí pohlavními procesy, je vlastně „nesmrtelná“. Je možné, že po splynutí gamet dochází v zygotě k reparaci většiny mutac, ke kterým došlo v germinální linii během života mnohobuněčného organismu.
Somatické buňky takovým procesem neprocházejí. Zhoršuje se jejich funkčnost. Tkáně i celý organismus stárne.
K vysvětlení Hayflickova limitu je mnoho teorií, např. postupné zkracování telomer chromozomů během mitotických dělení a obnovení jejich původní délky po indukci enzymu telomerázy v některé fázi pohlavního rozmnožování.
Proteom –obsah všech proteinů buňky, který vyjadřuje její biochemický potenciál. Obsah proteinů souvisí s transkriptomem, ale není identický. Obsah proteinů závisí také na rychlosti jejich transkripce a degradace (obratu proteinu v buňkách). Studium složení proteomu se nazývá protein profiling. Protein profiling postaven na proteinové elektroforéze a hmotnostní spektrometrii.
Proteinová elektroforéza – specifika. Isoelektrická fokusace – gel může být v pH gradientu, protein doputuje do pH, které je stejné jako jeho pI (izoelektrický bod, kdy se kladné a záporné náboje proteinu vyrovnají). SDS – sodium dodecyl sulfát lze využít k denaturaci proteinů a jejich obalení homogenním nábojem → proteiny jsou pak rozdělené podle svých velikostí. Dvojrozměrná elektroforéza – nejdříve provedena isoelektrická fokusace, a posléze proteiny denaturovány v SDS a po otočení gelu o 90° je puštěna SDS-PAGE.
Hmotnostní spektrometrie. Peptide mass fingerprinting – pomocí MALDI-TOF hmotnostní spektrometrie jsou peptidy ionizovány a na základě doby průletu hmotnostním spektrometrem je určeno jejich mass-to-charge poměr, z kterého lze odvodit jejich molekulovou hmotnost, a odtud odhadnout strukturu. MALDI-TOF funguje jen pro peptidy o velikosti do 50 amk, proto proteiny nejdřív štěpeny proteázou na fragmenty.
Často třeba porovnat rozdílné množství proteinů ve dvou proteomech. Označím proteomy dvěma různými fluorscenčními značkami, a poté je rozdělím 2d elektroforézou a osvěcováním gelu za různých vlnových délek porovnám množství daného proteinu v obou proteomech. Přesnější metoda: K obou proteomům přidány ICAT tagy (isotope coded affinity tag), tyto tagy se liší v přítomnosti buď obyčejného vodíku, nebo deuteria. Při použití MALDI-TOF můžu rozlišit stejné proteiny z dvou různých proteomů podle přítomnosti deuteria ve značce, a porovnat jejich relativní množství podle relativní intenzity signálu z MALDI-TOF spektrometru.
Supresorová mutace. Maskuje účinek přímé mutace; intragenová (mutace v témže genu, ale na jiném místě) X intergenová (mutace v jiném genu než přímá mutace)
Enhancerová mutace. Opak supresorové; zvýšení intenzity mutačního fenotypu; často letalita.
Buněčný typ: somatické buňky / buňky zárodečné linie
Typ chromozomu: autozomální / gonozomální
Molekulární změna: substituce / inzerce / delece
Jedna mRNA kóduje několik proteinů, ty kódovány za sebou a transkribovány jako jednotka – operon. Operony umožňují syntetizovat určité skupiny proteinů ve vzájemném poměru a také v časové souslednosti (translace probíhá vzápětí po transkripci).
Regulace operonu alostericky regulovaným proteinem – inhibitorem či aktivátorem, vazbou na DNA, inhibitor fyzicky brání vazbě polymerázy. Alosterická molekula účinek zvrátí. Místo v operonu, kam se váže inhibitor/aktivátor se nazývá operátor. Př. laktóza je alosterický regulátor inhibitoru lac operonu. Operátory často palindromy →represor (inhibitor) homodimer →kooperativní afinita k operátoru.
Aktivátor nabízí po vazbě na operátor svůj povrch RNA polymeráze, která ho tak snadno rozezná a najde místo, které bude transkribovat.
Atenuátor – tvoří určitou vlásenku, která brání transkripci, za podmínek, kdy má být transkripce inhibována – například když dostatek produktu reakce katalyzované proteinem, který kóduje gen, jehož transkripce je inhibována.
Regulační sekvence – enhancery a silencery – kdekoli na DNA, uvnitř genu i daleko mimo něj. Regulace proteiny nehistonového typu.
Promotorem u eukaryot je TATA box, na něj se váže TATA bindingg protein, s ním asociují transkripční faktory a tvoří iniciační komplex transkripce.
Regulace represory – alostericky je aktivují hormony. Hormon-represorový komplex buď působí přímo na DNA, nebo aktivuje proteinkinasy, fosforylující bílkoviny, které se váží na DNA a ovlivňují transkripci. Hormony také aktivují adenylát cyklázu, ta tvoří z aAMP cAMP, cAMP aktivuje proteinkinázu atd.
Regulace transkripce také prostřednictvím modifikace chromatinu, genové dóze (kolikrát je gen pro daný protein zastoupen v genomu a kolikrát tedy může být souběžně transkribován).
Skládají se z rRNA a proteinů. Enzymová aktivita ribozómů vykonávana RNA molekulami, proteiny mají stabilizační funkci.
Mají podobnou strukturu u prokaryot i u eukaryot.
Prokaryota. Ribozómy 70S. Skládají se z malé 30S a velké 50S podjednotky. Malá podjednotka se sestává z 16 S RNA podjednotky navázané na 21 proteinů. Velká ribozomová podjednotka sestává se z 5S RNA, 23S RNA a 31 proteinů.
Eukaryota. 80S ribozóm, malá podjednotka 40S, velká 60S. Malá podjednotka 18S RNA a 33 proteinů, velká podjednotka 5S RNA, 5.8S RNA, 28S RNA a 46 proteinů.
evoluční model nukleotidových sekvencí
Předpoklady:
Možný vznik eukaryot z konsorcia archea, protobakterií a velkých cytoplasmatických virů.
Vakcinační teorie. Genomoví parazité (např. viry) mohli ochraňovat před nebezpečnými viry.
Teorie nekódující DNA.
Teorie pásu cudnosti.
Submikroskopičtí obligatní celulární parazité. Nemají vlastní energetický metabolismus, nerostou, vznikají spojením jednotlivých komponent. Dělit se dokáží jen v buňce.
Virová částice se nazývá virion. Minimální výbava virionu – dědičná informace (RNA / DNA) a virová kapsida (proteinový obal NK). Dále může virus obsahovat další obal kolem kapsidy a různé enzymy a proteiny.
Virové genomy jsou malé a komplexní. Genom je často složen pomocí virových histonů a asociován s proteiny kapsidy. Genom musí být čitelný pro replikační a transkripčně translační aparát buňky.
Kapsida je fyzikálně a chemicky odolná. NK kóduje i další potřebné proteiny.
Všechny možné variace způsobů replikace (dsDNA, ssDNA, dsRNA, (+)(-)ssRNA).
Nesou informaci nutnou pro svůj vlastní pohyb (geny kódující enzymy umožňující transpozici).
Neschopnost pohybu bez účasti autonomních elementů. Mohou je však přenést. Obvykle to bývali autonomní elementy, které ztratily gen/y (či mají poškozený gen/y) pro enzym umožňující transpozici.
Vše, co vede k přeměně nascentního proteinu (transitovaného polypeptidového řetězce) na aktivní formu.
Kovalentní modifikace bočních řetězců aminokyselin
Nekovalentní interakce
Kovalentní modifikace základní kostry polypeptidu – transport proteinů mimo buňku
Z jednoho genu můžeme vytvořit různé zralé RNA sestřihem různými způsoby. (vynecháme některé exony, zahrneme intron, alternativní konce)
Absence pohlavního rozmnožování a s ním spojené reparace mohou být příčinou stárnutí klonů somatických buněk u mnohobuněčných organismů.
Nemožnost korekce téměř neutrálních mutací za nepřítomnosti genetické rekombinace může být příčinou stárnutí mnohobuněčných organismů.
RNA polymeráze se skládá z podjednotek α, β, β', σ.
O specifitě RNA polymerázy rozhoduje σ faktor, který rozpoznává promotor.
Operon je několik po sobě jdoucích genů v bakteriální DNA, které mají společný promotor.
Transkripce pokračuje až po terminátor.
Signál v bakteriální DNA, který pozastavuje transkripci. V eukaryotech se transkripce ukončuje po cleavage a polyadenylaci nově syntetizované DNA.
Kovalentní vazby v proteinech – peptidová – amidová vazba mezi aminoskupinou jedné AK a karboxyskupinou druhé. Cysteinová vazba mezi 2 cysteiny – S-S vazba.
Primární struktura – spojení planárních C-N systémů (ve kterých vazby C=O a N-H směřují do opačných vrcholů rovinného obrazce) pomocí Cɑ uhlíků s připojenými R skupinami.
Dominantní. Pokud projevena pozdě v ontogenezi, přenos do dalších generace.
Recesivní. V populaci zachovány hlavně u heterozygotů. Neobvyklé štěpné poměry v potomstvu F2 generace.
Auxotrofní. Neschopnost syntetizovat určitou důležitou živinu.
Teplotně senzitivní. Produkt labilní za určitých teplot.
Životaschopnost pouze za přítomnosti supresoru.
Proces, během kterého jsou z pre-RNA vystřižené introny a spojené exony. Výsledkem je zralá RNA. Nejčastěji u mRNA. Existuje i u jiných typů RNA, např. tRNA.
Modely mutací a evoluce jsou budované nad přiřazeními k odhadnutí evoluční vzdálenosti dvojice sekvencí.
Evoluční vzdálenost je odhadovaný počet mutací, který se objevil od doby, kdy se dvě sekvence oddělily od společného předka.
Přítomnost dvou genových sad pocházejících od dvou jedinců umožňuje zygotě rozpoznat, ve kterém z řetězců DNA došlo k mutaci.
Dojde-li k bodové mutaci, mohou enzymy reparačního aparátu určit místo, kde k této mutaci došlo. Báze v řetězci zde spolu nepárují. Nemohou ale určit, ve kterém řetězci došlo k nukleotidové zaměně. Je-li v buňce druhá kopie daného úseku DNA, místo ve kterém spolu báze nepárují, může být opraveno podle sekvence druhé kopie daného úseku DNA. Mohou být opravovány i neutrální mutace.
Přesto by tento mechanismus mohl být dlouhodobě nevýhodný, protože by danému druhu bránil v evolučním přizpůsobování se probíhajícím změnám. Je tedy možné, že v genomu by mohly být takto chráněny proti změnám pouze určité úseky genů.
Výhodnost schopnosti opravovat mutace v germinální linii je do určité míry sporná, ale schopnost opravovat mutace v liniích buněk somatických je jednoznačně výhodná.
Ztrátová mutace. Snížení funkce (= leaky mutace) + ztráta funkce (= null mutace) mutovaného genu.
Zisková mutace. Zvýšení funkce; větší množství produktu; zisk nové vlastnosti
mobilní genetické elementy, transpozony, rozptýlené repetice
Transponovatelné elementy jsou úseky DNA schopné změnit svou pozici / pohybovat se v rámci genomu jednoho organismu (v širší def. i mezi organismy). Jsou to rozptýlené repetitivní sekvence.
Vyskytují se u archeí, bakterií, eukaryot i virů (Pandoraviry).
Transpozony se často šíří i horizontálně. V evoluci se střídají periody, kdy jsou TE aktivní a množí se, s periodami klidu.
Zpravidla se v genomu vyskytují pouze malá množství celých nepoškozených transpozonů. Většinu tvoří nefunkční, zkrácené či jinak poškozené sekvence transpozonů. Ale i poškozené se mohou kopírovat, pokud v genomu je alespoň několik nepoškozených kopií, které dodávají potřebné enzymy. Transpozony mohou tvořit významnou část genomu (1000 až 10.000 kopií, člověk 50 %, kosatec 98 %) .
Objev transponovatelných elementů na Ac/Ds elementech kukuřičných zrn (aktivátor - autonomní, disociátor - neautonomní).
Reorganizace DNA v důsledku rekombinací mezi 2 kopiemi transponovatelného elementu. Vznikají delece, inverze. Závisí na tom, zda jsou kopie přímé nebo invertované.
Záleží na místě inzerce. Možný vliv i po excizi elementu v rámci cut-and-paste transpozice. Transponovatelné elementy mají evolučně získanou tendenci se inzertovat do safe heavens, nekódujících částí genomů, kde jejich inzerce nepoškodí hostitele.
Centrální dogma popisuje cesty přepisu informace mezi nukleovými kyselinami a proteiny.
(Francis Crick, 1956)
Transkripce je přepis DNA do RNA.
-, nekódující
Antisense vlákno je vlákno, podle kterého se RNA přepisuje.
+, kódující
Sense vlákno má sekvenci shodnou s RNA.
Transkripční jednotka je oblast, která se přepisuje do RNA.
Enzym, který katalyzuje syntézu molekuly RNA z templátu DNA s využitím NTP.
Sekvence DNA, která zahajuje přepis genu. Zahrnuje sekvence rozpoznávané RNA polymerázou.
RNA polymeráza I = RNA polymeráza A: prekurzory rRNA, v jadérku.
RNA polymeráza II = RNA polymeráza B: hnRNA, v jaderné plazmě.
RNA polymeráza III = RNA polymeráza C: prekurzory tRNA a 5S RNA.
Terminace transkripce eukaryot pomocí terminačních faktorů, které rozeznávají terminační signál (sekvenci), jiné terminační signály a faktory pro každou RNA polymerázu.
Lokální prostorová struktura polypeptidu vycházející především ze vzájemného uspořádání planárních C-N systémů peptidové kostry polypeptidu, stabilizovaná vodíkovými můstky a absencí sterického bránění R skupinám. Různé R skupiny AK v peptidovém řetězci spolu interagují, a tak nutí peptidový řetězec, aby zaujmul sekundární, respektive posléze terciární strukturu.
Nukleotidové sekvence se vyvijí rychleji. Jsou vhodné pro blízce příbuzné organismy.
Proteinové sekvence se vyvíjí pomalu. Hodí se tedy pro vzdáleně příbuzné skupiny. Více konzervované než nukleotidové sekvence. Různé kodony jsou více preferované pro danou aminokyselinu v různých druzích.
Ribozomální RNA se též vyvijí pomalu.
Rozmnožování patří mezi vlastnosti živých systému, bez nichž by nebyla biologická evoluce.
Pohlavní rozmnožování je až moderní akt této evoluce.
Dříve nejspíše sloužilo k jiným účelům, ale časem se na něj nabalila řada adaptací.
Velká část předností nemohla působit od začátku.
Rozdíl teorií vznik pohlavního rozmnožování a jeho udržování.
rentgenové záření, γ záření a kosmické záření…
Ionizující záření navozuje strukturní změny chromozomů v důsledku dvojchromatidových zlomů. Proniká v různých vzdálenostech do tkání. Využívá se v klinické praxi.
UV záření způsobuje vznik thyminovch dimerů (mohou vznikat i TC, CC dimery) a cytosinhydrátu. Proniká do tkání pouze povrchovou vrstvou buněk. Je snadno absorbováno organickými molekulami. Nezpůsobuje ionizaci. Vede k exitaci elektronů do vyšší energetické hladiny, čímž způsobuje vyšší reaktivitu molekul.
Úpravy, kdy se z přepsané prekurzorové mRNA vytváří mRNA.
Zahrnují např. 5' čepičku, RNA sestřih, polyadenylaci.
„Standardní“ spliceozom má 5 snRNA typů: U1, U2, U4-U6, které tvoří spolu s proteiny snRNP, tyto snRNP vytváří spliceozomový komplex, který se asembluje pokaždé znovu na nové pre-RNA.
Nativní konformace. Proteiny se liší svým uspořádáním v prostoru. Protein je funkční v této konformaci. Energeticky nejvýhodnější.
Lze využít pro stromy do 20 taxonů.
U většiny druhů množících se nepohlavně musí být série nepohlavních množení čas od času přerušená pohlavním množením. Jinak by došlo k postupné degeneraci populace. Jediný cyklus dokáže geneticky omladit danou populaci.
V průběhu pohlavního množení byly pravděpodobně nějakým zatím neznámým mechanismem opraveny mutace a poškození genetického materiálu.
Somatické mutace. Projev u potomků somatické buňky; nepřenáší se gametami do potomstva; ztráta heterozygozity = mutace alely genu v somatické buňce, která už nese na homologickém CH mutovatou alelu téhož genu (retinoblastoma u člověka); dominantní mutace se projeví ve fenotypu
Gametické mutace. Přenos gametami do potomstva; dominantí mutace projev ve fenotypu potomstva
mRNA zprostředkuje převod sekvence DNA na sekvenci peptidu, mRNA však obsahuje kódující i regulační úsek.
U eukaryot – části ve směru 5‘→3‘:
• Metylguanosinová čepička – guanosin metylovaný na purinovém dusíku 7 (ten na imidazolovém jádře, který není vázán na ribózu) a navázaný 5‘→5’vazbou na transkript, metylace dále na 2’OH ribózy
o Prvního nukleotidu: čepička-1
o Prvních dvou nukleotidů: čepička-2
o Není: čepička-0 (jednobuněční)
• 5’UTR – untranslated region, nepodléhá translaci, včetně sekvence, která rozeznávána 18S podjednotkou ribozómu
• CDS – coding „DNA“ semence – kódující sekvence
• 3’UTR – untranslated region, včetně terminačního signálu AAUAA
• polyA konec
hnRNA = pre-mRNA, obsahuje introny a exony, postrádá metylguanosinovou čepičku a poly A sekvenci. Je procesována spliceozómy (eukaryota).
Small nuclear RNA
snRNA se podílí na vyštěpování intronů z hnRNA a maturuje ji tak na mRNA (splicing).
rRNA a ribozómy
Translaci zprostředkovávají ribozomy- ribonukleoproteinové komplexy. rRNA složky ribozomů. Prokaryota: 5S, 16S, 23S rRNA, ribozomové podjednotky: 30S, 50S. Eukaryota: 5S, 5,8S, 18S, 28S, ribozomové podjednotky: 40S, 60S. rRNA jednovláknové, občasné párování – vlásenky, helixy, laloky.
tRNA jsou nejmenší RNA (4 S). Přenos aktivovaných amk z cytoplazmy do ribozomu. Jedna tRNA na jednu bílkovinu. Na konci molekuly CCA sekvence, zde je akceptorové místo specifické vůči jedné z 20 kódovaných aminokyselin. Na druhém konci vlákna tRNA je antikodonová smyčka - zde antikodon komplementární k tripletu – kodonu na mRNA. Prostorově tvar jetelového listu, tři raménka konstantní, jedno variabilní.
Vazba s nehistonovými proteiny v chromatinu, aktivátory či represory genů.
nRNA označuje snRNA, cRNA a hnRNA a prekurzory dalších RNA.
Regulace transkripce prokaryot
Jedna mRNA kóduje několik proteinů, ty kódovány za sebou a transkribovány jako jednotka – operon. ORF – otevřený čtecí rámec – jeden translatovaný protein, operon – jedna transkribovaná mRNA – více ORFů.
Operony umožňují syntetizovat určité skupiny protienů ve vzájemném poměru a také v časové souslednosti (translace probíhá vzápětí po transkripci).
Regulace operonu alostericky regulovaným proteinem – inhibitorem či aktivátorem, vazbou na DNA, inhibitor fyzicky brání vazbě polymerázy. Alosterická molekula účinek zvrátí. Místo v operonu, kam se váže inhibitor/aktivátor se nazývá operátor. Př. laktóza je alosterický regulátor inhibitoru lac operonu. Operátory často palindromy →represor (inhibitor) homodimer →kooperativní afinita k operátoru.
Aktivátor nabízí po vazbě na operátor svůj povrch RNA polymeráze, která ho tak snadno rozezná a najde místo, které bude transkribovat.
Atenuátor – tvoří určitou vlásenku, která brání transkripci, za podmínek, kdy má být transkripce inhibována – například když dostatek produktu reakce katalyzované proteinem, který kóduje gen, jehož transkripce je inhibována.
Regulace transkripce eukaryot
Více RNA polymeráz s různou afinitou k určitým promotorům. Regulační sekvence – enhancery a silencery – kdekoli na DNA, uvnitř genu i daleko mimo něj. Regulace proteiny nehistonového typu.
Promotorem u eukaryot je TATA box, na něj se váže TATA bindingg protein, s ním asociují transkripční faktory a tvoří iniciační komplex transkripce.
Regulace represory – alostericky je aktivují hormony. Hormon-represorový komplex buď působí přímo na DNA, nebo aktivuje proteinkinasy, fosforylující bílkoviny, které se váží na DNA a ovlivňují transkripci. Hormony také aktivují adenylát cyklázu, ta tvoří z aAMP cAMP, cAMP aktivuje proteinkinázu atd.
Regulace transkripce také prostřednictvím modifikace chromatinu, genové dóze (kolikrát je gen pro daný protein zastoupen v genomu a kolikrát tedy může být souběžně transkribován).
Sada pravidel, kterými je informace obsažená v DNA a související molekule RNA překládaná do sekvence aminokyselin v proteinu.
Kodon. Trojice (triplet) nukleotidů na mRNA, na který se váže antikodon lokalizovaný na antikodonovém raménku v tRNA.
Degenerovaný kód. 64 kombinací tripletů, 20/21 AK. Kódování od 6 po 1 triplet na AK.
Univerzální kód.
Jednosměrný kód (degenerace jen ve smyslu více kodonů na amk, ne naopak).
AUG – start kodón + metionin
UGA – stop kodón + selenocystein
UAA – stop kodón
UAG – stop kodón
Wobbling. Nestandartní párování antikodónů na kodóny – U v 1. pozici tRNA antikodónu umí číst A i G v 3. pozici kodónu, G v 3. pozici antikodónu umí číst U i C v 1. pozici kodónu, inosin čte C, U, A.
Přidání několika adeninových nukleotidů na 3' konec nově syntetizované molekuly mRNA.
PRotein infectION
Nositelem infekce je zřejmě špatně složený protein. Tento se propaguje tak, že při kontaktu se správně složeným proteinem indukuje je přeskládání na prionovou formu, obvykle obsahující amyloidový sklad.
Amyloidový sklad agreguje do fibrilárních řetězců se sekundární strukturou β skládaných listů. Rostoucí konce řetězce se mohou větvit a dát tak vznik novým řetězcům prionů.
Př. onemocnění: u zvířat BSE (bovinní spongiformní encefalopatie) a scrapie, u člověka CJD (Creutzfeld-Jakobsova choroba), kuru a další.
Šroubovicovitá sekundární struktura daná opakováním stále stejné kombinace torzních úhlů.
Nejznámější pravotočivý ɑ helix – jediný helix stabilně v proteinech na delších úsecích. Aminokyseliny nejsou uspořádané přesně nad sebou. 3,6 AK na obrátku. Mezi kyslíkem C=O na n a vodíkem NH na n+4 AK je vodíková vazba, tyto vodíkové vazby podél osy helixu stabilizují ɑ helix, dále stabilizován díky tomu, že uprostřed něj není místo pro vodu, tudíž zde místo pro elektrostatické van der Waalsovy interakce. V pravotočivém helixu dále míří R skupiny více ven od peptidové kostry než by tomu bylo u levotočivého helixu. Určité R skupiny (např. příliš velké blízko sebe, stejně nabité blízko sebe) můžou helix destabilizovat. Často hydrofobní helixy na jednu stranu, hydrofilní na druhou. ɑ helix může z každé strany interagovat s jiným proteinem, jiným prostředím.
Relativní helikální tendence – některé AK mají větší tendenci tvořít ɑ helix, některé menší. Lze změřit na základě kontrolovaných výměn R skupin v rámci ɑ helixu. Histidin, asparagin, threonin, valin jsou s ɑ helixovou strukturou méně kompatibilní.
Prolin je pak zcela nekompatibilní s ɑ helixovým uspořádáním, ale tvoří polyprolinový II helix. Velmi prudce točený – 3 AK na obrátku, ale posun o 9,4 Å (onstrém). Levotočivý. Zásadní pro strukturu kolagenu.
Počet nezakořeněných stromů je:
RNA capping
Úprava 5' konce maturující RNA přidáním 5'-methylguanosinu.
Na 5' konci je nukleotid trifosfát. Jeden fosfát je odštěpen trifosfatázou (odštěpí gamma fosfát).
Guanylyltranferáza využije GTP za odštěpení pyrofosfátu a naváže guanosin 5' konec.
N7-guanosin methyltranferáza methyluje guanosin na pozici N7.
Vazba čepičky je 5'-5'. Tahle vazba není v buňce obvyklá a moc enzymů ji neumí štěpit.
První nukleotid je většinou adenosin.
Také známý jako hypotéza ostrých loktů. Předpokládá, že polymorfismus potomstva omezuje konkurenci mezi sourozenci. Tím, že se sourozenci od sebe liší, mají i odlišné ekologické nároky (např. potravní).
Bodové mutace. Záměna dvou nukleotidů (inzerce, delece, transverze – různý typ báze, tranzice – stejný typ báze)
Řetězcové mutace. Záměna celého úseku DNA (duplikace, inzerce = zmnožení řetězce DNA, delece = vystřihnutí úseku DNA, translokace = vzájemné vyměnéní úseku DNA, inverze = určitý úsek DNA je z chromozomu vystřihnut a vložen do stejného místa v opačné orientaci – může způsobit reprodukční bariéru a tím speciaci)
Chromozomální mutace. Translokace velkého rozsahu vznikající při mitóze. Následky drastické – mládě se ani nenarodí, nebo nemoci typu Downův syndrom.
Genomové mutace. Probíhají na úrovni chromozomů či chromozomových sad v důsledkem poruch v průběhu buněčného dělení (aneuploidie, polyploidie, autopolyploidizace, aloploidizace)
Pro transpozici nevyužívají reverzní transkriptázu.
Transpozice cut-and-paste. Při transpozici vznikají dvouřetězcové zlomy.
TIR elementy. Mají na koncích invertované repetice (TIR). Transpozice transpozázou.
Ac/Ds elementy u kukuřice.
P elementy. Nejvýznamnější elementy u Drosophily. Jejich kódování podléhá alternativnímu sestřihu – buď transpozáza nebo represorový protein.
Transpozice copy-and-paste, ale ne přes RNA intermediát. Při transpozici vznikají jednořetězcové zlomy (vznik kointegrátu).
Helitron elementy. Na koncích nemají TIR a netvoří TSD. Zejména u rostlin.
Maverick elementy. Na koncích TIR. Jsou velké (až 20 kbp). Nezjištěny u rostlin. Specifický mechanismus transpozice.
Cytochrom c po uvolnění z mitochondrie aktivuje APAF1 (apoptotic protease activating factor) tak, že na jeho Card doméně hydrolyzuje deoxyATP na deoxyADP, které se posléze uvolní. APAF se rozbalí a vystrčí tak Card (Caspase recruitment domain, na kterou se opět naváže nové deoxyATP), její místo zaujme cytochrom c. APAF agreguje svými Card doménami do heptameru v podobě sluníčka, kde uprostřed 7 Card, a na okrajích 7 paciček „držících“ cytochrom c. Na Card domény se přichytí 7 kaspáz. Kaspázy 9 se autoaktivují a posléze aktivují i ostatní (efektorové) kaspázy. Vzniklý heteroheptamer (7 kaspáz, 7 APAF) agreguje s druhým heteroheptamerem. Vzniká tak 28mer, kde kaspázy k sobě jako cívka z APAFů.
Proteolýza. Odstraňování proteinů, které se příliš pomalu či špatně balí/nebalí, nejsou správně asemblované, neasemblované, poškozené
Metionyl peptidázy odštěpují metionin z N konce amk (nebo formyl metionin), tím je protein destabilizován a rozpoznáván ubikvitin ligázou. Acetylace na N konci stabilizující faktor.
Ubikvitin – proteazómový systém. Ubikvitin ligáza rozpozná špatně složený protein, který vystavuje své hydrofobní sekvence do cytosolu, nebo protein, který postrádá na N konci (formyl)metionin, a naváže na jeho lysiny ubikvitiny. Ubikvitinylovaný protein rozpozná proteazóm, vychytává jej a degradativně štěpí.
Na zvýšené nežádoucí množství proteinu v určité situaci může také reagovat proces, který protein fosforyluje a takto jej opět destabilizuje a zprostředkuje ubikvitin ligáze.
Kvartértní struktura je počet a uspořádání mnoha složených podjednotek proteinu v jeden komplex. Stabilizace prostřednictvím hydrofobních interakcí, disulfidických můstků, iontových interakcí, vodíkových můstků.
Fibrilární proteiny. ɑ-keratin tvoří coiled-coil dimery 2 ɑ-helixů, tedy levotočivé nadšroubovice dvou pravotočivých ɑ helixů (s posunem na obrátku v ɑ helixu 5,1 Å, tedy méně než ve volném ɑ helixu), přičemž střídání orientace zvyšuje mechanickou pevnost. Tyto dimery se k sobě přikládají ve struktuře vyššího řádu tvoříce protofilamenta. Protofilamenta tvoří mikrofibrily, ty makrofibrily a makrofibrily vyplňují buňky, které keratin vytváří → rohy, nehty, atp. Fibroin – pro fibrilární strukturu nyní základem β skládaný list, mezi antipararelními řetězci jsou prokládany menší a větší R skupiny – zde alaninové a glycinové. Fibroin spolu se sericinem tvoří hedvábí – ohebná, ale neroztažitelná vlákna fibroinu (logické – β skládaný list).
Kolagen – levotočivý polyprolinový II helix tvoří trojitou šroubovici spolu s levotočivým polyglycinovým helixem. Kolageny skupina proteinů vytvářejících vlákna o různé pevnosti a dalších mechanických vlastnostech, obecně nejvíce abundantních proteinů v těle.
Globulární proteiny. Globulární polypeptidové podjednotky asemblují do funkčního supermolekulárního komplexu, někdy i s částmi RNA.
Celková struktura polypeptidu daná zejména hydrofobními silami, vzájemnými iontovými interakcemi R skupin, stabilizovaná dále disulfidickými a vodíkovými můstky. Terciární struktura se skládá ze supersekundárních struktur a z domén.
turns
loops
Extendujeme-li peptidový řetězec k torzním úhlúm blízkým 180°, a přiložíme-li 2 takové řetězce k sobě, aby mezi jejich C=O a NH skupinami vznikly vodíkové vazby. V β listu obvykle 6 takových řetězců přiložených k sobě a o delce 6 zbytků (jsou to průměrné hodnoty).
Pararelní listy jsou méně stabilní než antipararelní β listy. Atomy jsou dále od sebe. Netvoří tak silné vodíkové vazby. ntipararelní β list má jednotlivé řetězce cik-cak, proto jsou blíže k sobě.
Aby mohl být určitý znak předmětem přirozeného výběru není nutné, aby přímo zvyšovaly životaschopnost či plodnost svého nositele.
Stačí, když zvýší šance, že blízcí příbuzní (nejčastěji potomci a sourozenci) se dožijí reprodukčního věku. Jedná se o vlastnost zvyšující inkluzivní zdatnost jedince.
U tohoto znaku se uplatňuje příbuzenský výběr (kin selection). Příbuzenský výběr se ve svém mechanismu blíží výběru individuálnímu.
Vychází ze skutečnosti, že areál výskytu kteréhokoli druhu je většinou v té či oné míře heterogenní. Na každé mikrostanoviště se přitom dostane v každé generaci víceméně náhodný vzorek potomstva různých rodičů. Jedinci si mezi sebou na stanovišti konkurují a pouze nejlepší z nich v konkurenci zvítězí a zanechají potomstvo, tj. jejich fenotyp nejlépe odpovídá vlastnostem daného mikrostanoviště.
změny smyslu (vlivu na translaci)
Synonymní mutace. Substituce v jedné bázi, která nemění kódovanou AK.
Missense mutace. S chybným smyslem. Změna kodonu pro jednu AK za kodon pro jinou AK.
Nonsense mutace. Nesmyslná substituce vedoucí ke vzniku stop kodonu na místě kodonu pro AK.
U kladogramu větve nenesou žádnou informaci o evoluci (nekorespondují s množstvím změn v genech).
U fylogramu větvě představují množství evoluční divergence.
Formát, který je reprezentovaný vnořenými závorkami. Na fylogramu založený formát obsahuje délky větví.
Kořen umístíme doprostřed mezi dva nejvzdálenější taxony ve stromě. Předpokládá konstantní rychlost evoluce.
Outgroup je taxon, která je dost příbuzný na to, aby byla možná interfence s daty, ale dost vzdálený na to, aby byl jasný outgroup. Často určený z nezávislého zdroje informací. Př. outgrupu - ptačí sekvence u fylogenetické analýzy savců.
Část neutrálních mutací je slabě negativní. V obrovské populaci by se chovaly negativně.
Indukované mutace sou způsobené mutageny, což jsou látky, faktory vnějšího prostředí, které indukují vznik mutací. Jsou různé povahy, biologické, fyzikální a chemické.
Z plazmidu do plazmidu, či z plazmidu do bakteriálního chromozomu.
Proteazom váže (poly)ubikvitinovou značku na proteinu a degraduje jej – proteolýza na 8 zbytků dlouhé peptidy.
Proteazomy jsou tvořeny na sebe přiléhajícími 4 kruhy. Každý kruh o 7 proteinových podjednotkách. 4 kruhy vytváří tunel – centrální pór, na vnější kruhy (kruhy „ɑ podjednotek“) jsou navázána víčka – caps (na každý kruh 1), spolu s kruhy ɑ podjednotek kontrolují vstup proteinů do centrálního póru. Vnitřní kruhy jsou tvořeny 7 „β podjednotkami“, tyto obsahují 3 až 7 aktivních proteolytických míst a zde dochází k degradaci.
α domény jsou tvořeny svazkem 4 a více α helixů. Např. lidský růstový hormon.
Výskyt dané mutace vyjádřen jako podíl mutantních jedinců v populaci. Vyšší frekvence mutací u samců (vyšší selekční tlak na X chromozom a vyšší počet buněčných dělení během spermatogeneze).
Polypeptidy o velikosti více než 200 aminokyselin tvoří globulární struktury zvané domény. Jsou strukturně autonomní, takže se protein může rozpadnout na jednotlivé domény zachovávající si svou strukturu. Zpravidla nesou nějakou funkci.
Pozorujeme je na konkrétních oblastech proteinů, ale jen jako součást něčeho většího – domén.
Dva β listy pravotočivě spojené s ɑ helixem. β listy v globulárních proteinech mají pravotočivý zkrut (způsoben R skupinami AK a souvisí s jejich L chiralitou), což může usnadňovat zaujetí pravotočivého spoje.
Určitá aplikace evolučního principu Červené královny. Princip pojmenovaný podle knihy Lewise Carrolla.
Říká, že v některých situacích je nutné běžet rychle kupředu, abychom zůstali aspoň na místě. Abychom se pohnuli vpřed, nestačí jen běžet, je nutné běžet rychleji než ostatní.
Hypotéza uvažuje skutečnost, že v prostředí, v němž za většinu selekčního tlaku jsou zodpovědné především biotické faktory, především paraziti a predátoři, je mnohdy výhodné se lišit od vlastních rodičů a od většiny dalších jedinců stejného druhu.
Extrémní tlak tohoto druhu vykonávají právě parazitické organismy, bakterie, viry... Populace hostitelského organismu může být zdecimována svým parazitem. Přežijí jen ti rezistentní, kteří dají vzniknout nové populaci jedinců. Parazit má ale v koevolučních zápase neustále náskok (kratší generační doba oproti hostiteli, větší selekční tlak...). Jediná účinná protistrategie hostitele je produkce různorodého potomstva. Odolnost proti epidemii přitom vykazuje výrazně negativní dědičnost.
Počet mutací v dané pozici za jednotku času všech členů populace.
Fylogenetický strom ukazuje evoluční vztahy mezi různými taxony, u nichž se věří, že mají společného předka.
Fylogenetika se zabývá studiem evoluční příbuznosti napříč různými skupinami organismů (např. druhy, populace).
Informace můžeme získat z fosilních záznamů, které obsahují informace o morfologii předků běžných druhů, avšak pro některé organismy nejsou dostupné (např. mikroorganismy...).
Dalším možným zdrojem jsou geny. V průběhu času shromažďují mutace způsobující fenotypové změny. Je pro ně dostupné větší množství dat.
Předpoklady:
Pohlavní rozmnožování.
Amfimixis, tj. střídání redukčního dělení meiózy s obnovením diploidie zárodečné buňky zygoty syngamií, tj. splynutím jaderného materiálů dvou haploidních pohlavních buněk pocházejících zpravidla od dvou jedinců stejného druhu.
Nepohlavní rozmnožování.
Automixis. Rozmnožování zahrnující obnovení diploidie splynutím dvou haploidních produktů meiózy stejného jedince.
Apomixis. Rozmnožování nezahrnující meiózu.
Klasický darwinismus je založen na postupné kumulaci mikromutací, tedy mutací, které způsobují malé změny oproti původnímu stavu.
Existují ale i makromutace, jejichž vlivem se stavba či fungování těla změní výrazným způsobem (třetí ruka, jedna noha...). Je však otázka, zda by takovýmto způsobem mohly vzniknout některé zásadní nové orgány jako např. křídla apod. Makromutace existují, ale jejich role v evoluci je nejistá. Jedině díky makromutacím můžou vzniknout mezidruhové rozdíly.
Spontánní mutace vznikají přirozeně bez známé příčiny.
Při deaminaci dochází k nahrazení aminoskupiny (-NH2) ketoskupinou.
Cytosin. Hydrolýza na uracil.
5-methyl-cytosin. Hydralýza na thymin. Místo nejčastějších mutací u obratlovců.
Adenin. Vzniká hypoxantin, který se raději váže na cytosin. Vzniká tedy v podstatě GC pár.
Guanin. Vzniká xantin, který se páruje s thyminem. Nový pár je v podstatě AT.
Ztráta purinové / pyrimidinové báze a vznik apurinického / apyrimidinového místa (AP místa).
Př: ztráta purinové báze (A, G) ⇐ přerušení glykozidické vazby mezi deoxyribózou a purinem
Sklouznutí (slippage) je sklouznutí DNA polymerázy během replikace, lokální denaturace a následná reparace. Dopředné sklouznutí – delece, zpětné sklouznutí – adice. Může k němu dojít kdekoliv v DNA. Nejčastěji se tak děje v repetetivních sekvencích.
Báze je pozměněná změnou pozice vodíkového atomu. Pozmění se způsob tvorby vodíkových můstků, čímž se změní párování. Stabilní formy bazí – keto (G, T) a amino (A, C), méně stabilní enol a imino.
Dva β listy jedním směrem, oddělené mezi sebou, vlásenka je odděluje od dalších dvo β listů jdoucích opačným směrem, mezi sebou také oddělených; toto se přehne tak, že 1. a 4. a 2. a 3. β list vedle sebe.
Dva β řetězce spojené β obrátkou.
Fotolyáza opraví pyrimidinové dimery. Odstranění metylace methyltransferázou.
β domény jsou tvořené β listy. Dva složené β listy tvoří sendvič. Pokud budeme β list stáčet, bude mít tendenci se kroutit. Můžeme z něj vytvořit soudek (β-barrel). Velkým soudkem může procházet molekula vody. Př. membránové proteiny, kanály – poriny. Kombinace řeckých klíčů.
Kombinované s dalšími strukturami.
Pohlavní rozmnožování úzce souvisí se vznikem fenoménu biologického druhu. Ke vzniku mohlo dojít až se vznikem pohlavního rozmnožování.
Nepohlavně se množící organismy. Druhy v pravém slova smyslu neexistují. Organismy často vytváří jakousi spleť více či méně si podobných a více či méně si příbuzných genealogických linií.
Např. pampeliška.
Pohlavní rozmnožování. Je s ním spojené neustálé promíchávání genů v rámci společného genofondu. Je to nejdůležitější mechanismus druhové koheze, což je mechanismus udržující po dlouhé období vlastnosti příslušníků jednotlivých druhů v určitém úzce vymezeném rámci.
Mnoho nevýhod:
Mutace jsou změny ve struktuře genetického materiálu, při nichž se mění smysl genetické informace, aniž by byla porušena syntaktická pravidla jejího zápisu. Jako mutace označujeme změny sekvence DNA.
Je třeba rozlišovat mutace, respektující pravidla zápisu do DNA, a poškození DNA. Mutace jsou největším zdrojem genetické variability.
Genové mutace. Postihují jen jeden gen.
Chromozomové mutace. Změna struktury chromozomů, pořadí genů, polohy centromer.
Genomové mutace. Celková změna genomu (polyploidizace, aneuploidizace).
Mismatch repair systém opravuje špatně zařazené nukleotidy při replikaci. Opravuje chyby, které neopravila DNA polymeráza.
Systém musí rozpoznat, kterou bázi při nesprávném párování vyměnit, musí vědět, které vlákno sloužilo jako templát při proběhnuvší replikaci.
U gramnegativních bakterií je templátové vlákno metylováno, nové vlákno ještě ne. U ostatních prokaryot a eukaryot není mechanizmus jasný, u eukaryot je vlákno ne-templátové pravděpodobně odlišeno přítomností nicků. Ty se objevují i ve vedoucím vlákně. Zda jsou tam uměle zavedeny, není jasné. Proteiny u E. coli– MutS, MutL, MutH, svorkový protein PCNA
Transkriptom. Obsah RNA v rámci buňky, který odpovídá profilu genové exprese dané buňky. mRNA v různých množstvích.
Transkriptomika se snaží mRNA identifikovat, a nejlépe i jejich poměrné zastoupení v buňce. Nejpřímější cesta, ale zdlouhavá, je vytvořit podle mRNA cDNA knihovnu a všechny klony pak srovnávat s genomickou knihovnou. Transkriptomické metody umožňují práci urychlit.
SAGE (Serial analysis of gene expression). Vychází z toho, že pouhých cca 12 nukleotidů stačí na to, aby byla daná cDNA jednoznačně přiřazena k sekvenci genu na genomové DNA. mRNA jsou naloadovány do chromatografického sloupce, který obsahuje oligodT sekvence (komplementární k 3‘ polyA koncům mRNA) navázané na pevnou matrix (stacionární fáze). mRNA jsou zachyceny na oligodT, a převedeny (pomocí reverzní transkriptázy a DNA polymerázy) na cDNA. Tyto cDNA štěpeny reverzní transkriptázou, která rozeznává krátká restrikční místa→ štěpí často na malé sekvence. Na pevné matrix nakonec zbydou navázané jen krátké sekvence cDNA, zbytek eluován. Na každou cDNA je navázán linker s restrikčním místem pro BamHI, restruiktázou, která štěpí 10-16 nukleotidů za rozpoznávaným místem. Použití této restriktázy vzápětí umožní eluaci krátkých cca 12 nukleotidů dlouhých fragmentů cDNA. Fragmenty jsou zligovány dohromady (vytvořen jejich katenan) a sekvenovány. Sekvence jednotlivých cDNA fragmentů lze v katenanu odlišit, neboť jsou odděleny restrikčními místy pro BamHI. SAGE umožňuje zjistit složení transkriptomu, ale není příliš přesné pro zjišťování poměrného zastoupení jefdnotlivých složek transkriptomu.
K tomu slouží velice sofistikovaný typ hybridizační analýzy – microarray. Klony všech genů daného genomu naneseny na sklíčko/několik sklíček, do malých jamek po vzorku z jednoho klonu. mRNA studované buňky pak převedena na cDNA, cDNA označena fluorescenčními značkami, a nanesena na microarray. Nechá se proběhnout hybridizace, zbytek odmyt. Poté studováno, na kterých bodech (jamkách) microarray je fluorescenční signál, tedy které z klonů našli partnera k hybridizaci v daném transkriptomu. Tak můžeme zjistit, co je v buňce transkribováno za různých podmínek prostředí, respektive v různě diferenciovaných buňkách.
DNA chip. Microarray nevhodné pro velké genomy, udělat 30000 klonů pro všechny lidské geny je velmi náročný úkol. Místo toho DNA chipy – na silikonový plátek jsou chemicky nasyntetizovány 20 – 30 b dlouhé oligonukleotidy, komplementární ke všem genům studovaného genomu, v hustotě až milion oligonukleotidů na cm2. Hybridizace pak prováděna na DNA chipech.
Topoizomerázy jsou enzymy měnící topologii DNA. Odstraňují pozitivní nadobrátky vznikající před replikační vidličkou. RNA primery jsou na konci replikaci nahrazeny DNA polymerázou I a nicky jsou zaligovány DNA ligázou.
Typ I produkuje ssDNA zlom (nick). Uchovávají energii ve formě fosfotyrosinu (fosfát z nukleotidu se z jedné strany naváže na tyrosin). Reakce je reverzibilní (fosfát se po určité době spontánně naváže zpět na nukleotid). Reakce tedy nepotřebuje přísun energie ve formě ATP.
Typ II produkuje dsDNA zlom. Jsou aktivovány navázáním ATP a dimerizací v místech překřížení chromozomů. Vytvoří zlom v jednom vlákně DNA, protáhnou druhé vlákno DNA a uzavřou zlom. Hydrolýza ATP je pak vrátí do původniho stavu, ve kterém mohou vyhledat další křižující se vlákna. Topoizomerázy II jsou mimo jiné schopné oddělit propletené cccDNA (zásadní při replikaci prokaryot).
ɑ/β soudek, součástí trióza-fosfát-izomerázy, ale i dalších struktur. Je to jeden z nejstabilnějších proteinových tvarů v přírodě.
Je vlastně z β listů, které jsou poskládané. Spojení od N k C mezi dvěma paralelními je realizováno helixem, když se to stočí do válce, vznikne uprostřed β řetězec, na povrchu probíhají ɑ-helixy, jsou vůči sobě pootočené.
Částečně zanesené evoluční info o potenciálně odlišné rychlosti změn v různých větvích.
Na začátku strom - hvězda.
Vypočíst matici vzdáleností pro všechny dvojice sekvencí. Modifikovat vzdálenosti kvůli kompenzování dlouhých hran.
Vybrat minimální vzdálenost Di,j.
Definovat nový vrchol k a nastavit vzdálenost dkm. Přidat k do stromu.
Kvantitativní měřítka jako vzdálenosti a podobnosti mezi druhy.
Nic neříkají o stavu předků ve vnitřních uzlech. Spoustu informací jsme ztratili převodem na matici vzdáleností.
biologická zdatnost
Kvantitativní reprezentace přirozeného a pohlavího výběru. Lze ji definovat různě.
Může ji posuzovat např. podle toho, kolik daný jedinec zanechá potomků. Lepší je počet prapotomků nebo praprapotomků. Je to na hovno, pokud jsou to chcípačci, kteří se stejně nerozmnoží.
Biologickou zdatnost lze vyjádřit absolutně i relativně, kdy jedinec s největším počtem potomků má fitness = 1.
Myšlenka možnosti přechodu jednoho druhu v jiný prostřednictvím přepínání alternativních ontogenetických programů. Př. když se pšenici nedaří, začne se měnit na žito, kterému by se za daných podmínek dařilo lépe.
Tato myšlenka není úplně zavrhnutelná, ale v rámci celého lysenkismu (falšování, ideologie) je mimo.
Část chybně spárovaných bazí opraví DNA polymeráza – palm doména kontroluje párování právě připojeného nukleotidu, pokud zjistí chybu, tak se primer*templát komplex uvolní z polymeračního místa (thumb a finger) a jde na opravné místo na palm doméně, kde nastupuje 3‘→5‘ exonukleázová aktivita palm domény.
Oprava poškozené DNA.
Sbalování proteinu je řízeno termodynamicky – protein se sbaluje do energeticky nejvýhodnější konformace. Toto sbalování ale nemůže probíhat zcela náhodně, protože možných konformací je ohromné množství; kdyby měl protein postupně procházet mnoha možnými konformacemi, trvalo by sbalování mnohem déle, než ve skutečnosti pozorujeme.
Dojde k hydrofobnímu kolapsu, dovnitř proteinu jdou hydrofobní složky. Protein vytváří primordiální globuli o větším objemu, ale již podobném konečnému proteinu. Sekundární struktury se pak (na základě primární struktury) ustaví po celém proteinu a určí jeho detailní terciární strukturu.
Unweighted Pair Group method Using Arithmetic Average
Předpoklad: molekulární hodiny – všechny taxony se vyvíjí konstantní rychostí a všechny jsou stejně vzdálené od kořene.
Metoda je založená na klastrování sekvencí:
Předpokládá molekulární hodiny, kde se předpokládá, že divergence sekvence se odehrává stejnou rychlostí kdekoliv ve stromu. Součet časů podel každé větvě je stejný. Pokud je to pravda, jedná se o správně vytvořený strom. Nebere v úvahu různé substituční rychlosti na různých větvích.
Je validní pouze pro ultrametrické vzdálenosti. Pro každou trojici sekvencí si, sj, sk jsou vzdálenosti dij, djk, dik buď všechny stejné, nebo dvě vzdálenosti jsou stejné a zbývající je menší. V ultrametrickém stromu jsou vzdálenosti z kořene do listů konstantní.
Změna fitness za generaci je rovna variabilitě v populaci.
Místa výskytu mutací nejsou v řetězci DNA rozmístěna rovnoměrně – častěji k nim dochází na horkých místech (hot spots). Změny frekvence mutací pozorujeme i v čase, kdy jich v některých místech evoluce vzniká podstatně více – není úplně objasněno proč – sekvenční motiv (AT sekvenční motivy), vnější podmínky, pohlavní rozdíly (samci mutují častěji)... Jsou také místa, kde sice nevzniká více mutací, ale kde se mutace snáze fixují.
Některé organismy dokážou ve stresových podmínkách začít mutovat rychleji, což jim zvýší šanci na přežití. Někteří autoři se domnívají, že nejen mutují rychleji, ale i cíleně, např. trypanosoma dokáže vytvářet mnoho různých variant povrchových proteinů a dělá to záměrně v určitý čas a za určitých podmínek.
Liší se mezi pohlavími. Častěji mutují samci – při vzniku spermií mohou zkoušet evoluční novinky. Samice jsou konzervativnější, má jich méně a nevyplatilo by se jí riskovat.
Role mutátorů – patogenní bakterie mají v populaci hodně mutátorů, snaží se tak najít optimální virulenci.
Pravděpodobnost pozorování našich dat za předpokladu, že platí náš model.
model = strom + parametry
Pravděpodobnost poskytuje pravděpodobnosti sekvencí pro daný model jejich evoluce v určitém stromě. Čím pravděpodobnější jsou sekvence pro daný strom, tím více je strom preferovaný. Berou se v úvahu všechny stromy.
Paralela k fylogenezi: máme model (strom + parametry evoluce) a zkoumáme jaká je pravděpodobnost, že na ně budou sedět naše data, testujeme postupně stromy (analýza tedy vezme 1 strom, spočítá L, pak vezme další, a pokud ten je lepší tak pokračuje s ním, pokud ne tak s původním) – počet kroků = počet generací -> vyhledáme tímto nejlepší strom.
Příklad s házením mincí: hodím 10x mincí, jaká je pravděpodobnost (likelihood, L), že mi padne 5 x hlava a 5 x orel? (náš strom je jakoby to, co „má“ padnout, parametry jsou třeba pravděpodobnost, že padne hlava, kolikrát jsme házeli apod.)
Pokud by mince byla nesouměrná, a měnila by se pravděpodobnost (p) padnutí hlavy, pak se zmenšuje i likelihood padnutí 5 hlav + 5 orlů
Nejméně anagenetických změn, nejpravděpodobnější průběh kladogeneze.
Metoda maximální parsimonie se snaží najít takový strom, kde bude, co nejméně změn.
Algoritmus má 2 části:
Samostatná existence cílených mutací by ale nestačila k lamarckistické evoluci. Naprostá většina mutací je náhodná.
První překážkou lamarckistické evoluce je neexistence zpětného toku z proteinů do DNA.
Druhou překážkou je Weismanovská bariéra mezi germinální a somatickou linií.
Třetí překážkou je fakt, že geneticka informace není přesný popis struktury.
Fotoreaktivace. Enzym DNA fotolyáza po osvětlení DNA UV zářením opraví pyrimidinové dimery. Využívá energii viditelného světla.
Odstranění metylace. Metyltransferáza přenese metylovou skupinu z 6-O-metylguaninu na cystein, energeticky velmi náročné.
Nativní prostorové uspořádání bílkoviny je určeno samotným pořadím aminokyselin v jejím řetězci. Nevýznamnější roli hrají aminokyseliny proteinového jádra a hydrofobní interakce mezi nimi. Rychlost sbalování odpovídá tomu, jak jsou od sebe vzdálené aminokyseliny, které na sebe vzájemně působí. Interagují-li spolu aminokyseliny, které spolu v řetězci sousedí, probíhá sbalování rychleji. Naopak je-li pro sbalení potřebná interakce mezi vzdálenými aminokyselinami, bude probíhat pomalu.
maximum likelihood -> pravděpodobnost dat ze stromu (modelu)
BT -> pravděpodobnost stromu/uzlu při datech (využívá k výpočtu tzv. inverzní pravděpodobnost)
Využívá komplexní samplovací metody (př. Markovské řetězce Monte Carlo).
minor a major groove
Jsou definované vzhledem N-glykosidické vazbě. Střidají se. Jsou určené rozpětím ribóza-fosfátových skupin. Ve velkém žlábku je možno rozlišit všechny typy párů bazí (A-T, T-A, C-G, G-C).
u purinu na té straně, kde je N3 a C4; u pyrimidinu C2
celá druhá strana, ve velkém žlábku je mnohem větší množství substituentů – ty jsou rozpoznávané regulačními bílkoviny, které se vážou na DNA v oblasti velkého žlábku
V malém rozdíl mezi (A-T + T-A) a (G-C + C-G). DNA vazebné proteiny proto rozlišují sekvence DNA přednostně na velkém žlábku. Rozlišení podle přítomnosti následujících skupin vyčuhujících z dvojice bazí do žlábku: A – akceptor vodíkové vazby (vodíku), D – donor vodíkové vazby (vodíku), M – hydrofobní metylová skupina, H – nepolární vodík. Rozměry žlábku mohou vykazovat lokální změny, baze mohou být vrtulovitě zkrouceny → DNA není perfektní šroubovie.
Přenos protonu od Brønstedovy kyseliny nebo na Brønstedovu zásadu snižuje volnou energii přechodového komplexu.
Typicky je součástí: hydrolýzy esterů, peptidů, reakcí fosfátových skupin, tautomerizací (keto-enol)
Příklad: hydrolýza RNA v rámci reakce rinonukleasy A
Homologie je znak zděděný od společného předka.
Př. končetiny obratlovců.
Analogie je jen podobný znak u nepříbuzných organismů.
Př. křídla u netopýrů a ptáků, ploutve u ryb a kytovců.
Oprava dvouvláknových zlomů (vznikají při ionizačním záření, vlivem oxidačních látek), kdy mezi vlákny zlomu dojde ke ztrátě nukleotidů..
Enzymy jsou proteiny s katalytickou funkcí. Vydá se jinou cestou, tím sníží velikost aktivační energie.
Důležité vlastnosti:
Oprava podle nepoškozeného vlákna (závislost excizní reparace na ds charakteru nukleové kyseliny). 3 obecné kroky:
Pro transpozici využívají reverzní transkriptázu. Copy-and-paste přes RNA intermediát. Představují značnou část genomu (u člověka 42 % / zatímco DNA transpozóny jen 2-4 %).
LTR retrotranspozóny. Na koncích mají LTR (long terminal repeats) – dlouhé přímé repetice. Velmi časté u rostlin, vzácnější u živočichů. Podobné retrovirům.
PLE retrotranspozony. PLE (penelope-like elements) na koncích mají LTR (můžou být invertované), tvoří TSD(target site duplication) – krátkou přímou repetici. Kódují endonukleázu.
Končí AT bohatou oblastí. Mechanismus transpozice viz výše.
LINES (long interspersed nuclear elements). Délka až několik kbp. Velmi časté u živočichů, vzácnější u rostlin.
SINES (short interspersed nuclear elements). Nevirové neautonomní retrotranspozóny. Nekódují reverzní transkriptázu. Pro transpozici využívají reverzní transkriptázu jiných elementů (většinou LINES). Tvoří TSD. Na jednom konci sekvence bohatá na AT o délce 100-500 bp.
Počítání počtu substitucí.
Algoritmus vypočte minimální cenu Rk(a) přiřazení písmene a do vrcholu k v místě u.
Cena S(a, b) pro každou substituci ve stromě.
Kladogeneze je postupné odštěpování evolučních linií od linie vedoucí ke společnému předku.
error prone repair
trans-lesion DNA synthesis: Když DNA polymeráza narazí neopravenou chybu, disouje i se svorkovým proteinem. Na její místo nastupuje translesion DNA polymeráza, která překlene místo poškození, ale generuje chyby (není tak závislá na párování bazí).
Důležité – když helikáza rozvíjí DNA, vzniká před ní nadvinutí (nadobrátka). Topoizomeráza typu I rozštípne jedno vlákno DNA, což umožní jeho otočení vůči druhému vláknu a odstranění nadvinutí.
lineární polymer, dvoušroubovice vzájemně antipararelních vláken. Tato struktura umožňuje semikonzervativní mechanismus replikace. Stabilita dvoušroubovice zajištěna vodíkovými můstky, stacking interakcemi.
Stacking interakce vznikají splýváním oblastí výskytu delokalizovaných π elektronů aromatických kruhů sousedících bazí, polaritou fosfátových skupin.
Schopnost reverzibilní separace vláken – denaturace a renaturace, možnost hybridizace (komplementární spojení 2 vláken z různých zdrojů – RNA a DNA). Jak ochotně DNA denaturuje závisí na obsahu GC (více GC → menší ochota denaturovat – 3 vodíkové vazby mezi G a C oproti 2 mezi A a T).
Názvosloví bazi a umět struktury.
Nukleosid. Báze + cukr (adenosin, guanosin, thymidin, uridin, cytidin).
Nukleotid. Tvoří primární strukturu. Je to spojení nukleosidu a kys. fosforečné (ATP. cAMP, GDP...)
Báze propojené přes (deoxy)ribózofosfátovou kostru. Polarita podle 5' a 3' konce ribózy. Báze mohou tautomerizovat – adenin a cytosin na iminoformu, guanin, thymin a uracil na enolformu.
International comittee for enzymes při IUPAC – 4 stupně třídění enzymů – označovány čísly.
V nejvyšší úrovni třídění 6 základních kategorií enzymů.
Oxidoreduktázy - přenos elektronů - redukčních ekvivalentů z donoru na akceptor. Systematický název: donor:akceptor-oxidoreduktáza → CoQ: cytochrom c oxidoreduktáza (komplex III). Příklady: NADH dehydrogenáza, cytochrom c oxidáza, malát dehydrogenáza, sukcinát dehydrogenáza, alkohol dehydrogenza, laktát dehydrogenáza, glutathion peroxidáza, glutathion reduktáza, kataláza, superoxid dismutáza (dizmutace superoxidu na kyslík a peroxid vodíku je redox děj).
Transferázy - přenos funkčních skupin. Systematický název:donor:akceptor skupina-transferáza → ATP:hexóza-fosfotransferáza (hexokináza). Příklady – metyltransferázy (HMT – metyluje histony→ silencing genů, DAM metyltransferáza metyluje adeniny DNA, využívají SAM jako koenzym), glykosyl transferázy (glykogen syntáza, větvící enzym), kinázy (fosfotransferázy – pyruvát kináza, bisfosfoglycerát kináza), acyltransferázy (malonyl-CoA:ACP acyltransferáza, acetyl-CoA:ACP acetyltransferáza – z komplexu FAS).
Hydrolázy – hydrolyticky štěpí substrát. Podtřídy podle typu substrátu, patří sem endonukleázy, exonukleázy, lipázy, fosfatázy, proteázy, glykosylázy (DNA glykosyláza – odebírá poškozené nukleotidy z DNA), helikázy (za spotřeby – hydrolýzy ATP rozmotávají DNA), F1FO ATP syntáza.
Lyázy – katalyzují nehydrolytické a neoxidační štěpení vazeb, často za vzniku vazeb nových (bez potřeby hydrolýzy ATP). Systematický název: substrát skupina-lyáza → oxalát karboxy-lyáza (oxalát dekarboxyláza). Příklady: Pyruvát dekarboxyláza, RuBisCO, PEP karboxykináza (dekarboxylace a fosforylace oxalacetátu na PEP během glukoneogeneze); hydratázy a dehydratázy – fumaráza, akonitáza, uhličitá anhydráza, enoláza (dehydratáza), enoyl-CoA hydratáza; adenylát cykláza.
Izomerázy - intermolekulární přestavby molekuly – izomerace. Systematický název: substrát typ izomerie izomeráza (nebo jen izomeráza) → fumarát cis-trans izomeráza (reakce na maleát). Příklady: Epimerázy (UDP-glukóza 4-epimeráza), PPIáza (peptidyl-prolyl cis,trans izomeráza, intramolekulární oxidoreduktázy (protein-disulfid izomeráza, trióza fosfát izomeráza), mutázy (fosfoglycerát mutáza), topoizomerázy (odstraňují nadvinutí DNA šroubovice).
Synthetázy (Ligázy) - při dodání energie z hydrolýzy ATP či jiného trifosfátu spojují dvě molekuly dohromady Systematický název: X:Y ligáza. Příklady: Aminoacyl-tRNA syntetáza; sukcinyl-CoA syntetáza, acyl-CoA syntetáza (β-oxidace MK); E3 ubikvitin ligáza, APF; pyruvát karboxyláza (glukoneogeneze), acetyl-CoA karboxyláza (syntéza mastných kyselin), DNA ligáza.
Eliminace vody z aktivního centra vede ke snížení dielektrické konstanty a k zesílení elektrostatických interakcí. Uspořádání nábojů v aktivním centru stabilizuje přechodové stavy reakcí. Distribuce nábojů kolem aktivního centra přivádí substrát do centra rychleji než by tomu bylo prostou difuzí.
Používá se pro rekonstrukci kladogeneze, protože když dva druhy sdílí hodně pleziomorfií, nemusí si být příliš příbuzní, ale mohou se jen málo měnit a žít třeba ve stejném prostředí. Ale když sdílí hodně synapomorfií, mají asi společného předka, který není předkem ostatních studovaných druhů
Jean-Baptiste Lamarck
před Darwinem (před r. 1859)
Př. žirafy mají dlouhý krk, protože se natahují pro listí do korun stromů.
Změnou dostupnosti reaktantů. Jestliže budeme ubrat substrátubereme-li substrát, nebo přidáváme produkt, měníme ΔG a tedy rychlost reakce daným směrem. → Metabolické dráhy – produkty jedné reakce substráty reakce další, jsou tedy neustále odebírány, což reakci předchozí pohání žádoucím směrem.
Alosterická regulace. Postranslační modifikace enzymu může vést ke změně jeho Km a vmax, například fosforylace a systémy kináz a fosfatáz.
Regulační proteiny mohou ovlivnit specificitu enzymu k substrátu, navážou se na enzym a onhibují/aktivují jej.
Regulace koncentrace enzymu v buňce. Proteolytická degradace, up/down regulace genové exprese.
Změna konformace, struktury enzymu. Chaperony, částečná (procesivní) proteolýza (chymotrypsin – štěpenímjednoho polypeptidu vzniká trimer, prokolagen, proinzulin – štěpením polypeptidu vzniká dimer, další proproteiny).
Umístění enzymu. Enzym může být přenesen z kompartmentu s dostupným substrátem někam, kde substrát není, případně je odebrán a přemístěn substrát.
Pleziomorfie je původnější forma znaku v dané linii.
Např. pětiprsté končetiny u tetrapodů, zuby u všech tetrapodů kromě ptáků a želv.
Apomorfie je odvozenější forma, přítomnost evoluční novinky.
Např. křídla ptáků, bezzubost ptáků a želv.
Místo thyminu se s adeninem páruje uracil. Mnoho typů RNA, běžně ssRNA, asociace s proteiny. Cukr, ribóza.
ssRNA může tvořit pravotočivou jednošroubovici stabilizovanou patrovými interakcemi. Vzhledem k možnosti intramolekulárního párování bazí může mít různou sekundární strukturu – dsRNA úseky, smyčky, vlásenky, pseudouzly. RNA může vstupovat se svými bázemi do interakcí, které vedou ke vzniku terciární struktury (vodíkové vazby s více než jedním partnerem) → tyto terciární struktury důležité pro ribozymy, což jsou RNA s enzymatickou aktivitou.
Příklady ribozymů: RNAáza P – ribonukleáza generující tRNA z větších prekurzorů, hammerhead ribozymy – sekvenčně specifické ribonukleázy viroidů (intracelulární parazité rostlin) – při množení viroidu dlouhé vlákno RNA, které naštěpeno hammerhead ribozymem.
Primární život mohl být založen výlučně na RNA.
Druh je skupina populací, mezi kterými může dojít ke křížení a které jsou reprodukčně izolovány od jiných populací (E. Mayr).
Není úplně pravda.
Jedním ze směrů popírajících darwinismus je mutacionismus. Jeho zastánci tvrdili, že nejdůležitějším zdrojem mutací jsou reparační procesy. Nebyli tak ale schopni objasnit vývoj adaptivních znaků. To vysvětluje mechanismus přirozeného výběru, který je nepostradatelný pro šíření výhodných mutací.
Metaloenzymy obsahují pevně výzané kovové ionty, nejčastěji Fe, Cu, Zn, Mn, Co.
Enzymy aktivované kovovými ionty jsou enzymy volně vážící kovové ionty z roztoku (a vyžadující je pro svoji aktivitu), např. ionty kovů alkalických zemin Na, K, Mg, Ca.
N-glykosidická vazba mezi bazí a deoxyribózou má možnost rotace, proto je možná syn a anti poloha báze vůči ribóze. N-glykosidická vazba je vazba vznikající mezi dusíkem báze a C1' uhlíkem ribózy.
Je popisovaná torzními úhly c zahrnujícími atomy O4’-C1’-N1-C2 u pyrimidinů a O4’-C1’-N9-C4 u purinů.
~ 0° (+/- 30°) = syn = cis
~ 180° (+/- 30°) = anti = trans
Pozn.: syn konformace lze uměle vyvolat např. bromací
U druhů s nepohlavním rozmnožováním je to jednodušší. Když dojde k mutaci, může přílušná linie dát vzniknout novému druhu. Zda vznikne závisí na tom, zda existuje v prostředí pro takový druh volná nika, nebo zda je jeho fitness podstatně vyšší než původní varianty.
Pohlavně se rozmnožující druhy to mají složitější. Nestačí odlišné fenotypy a niky, musí také vzniknout reprodukční bariéra. Aby mohlo dojít alespoň k fyletické speciaci, je nutné, aby nová mutace fungovala i v ostatních kombinacích genů než jen v mutantovi.
Charles Darwin
shrnuto v jeho knize „O původu druhů přirozeným výběrem“
A konformace. 11 bp na závit. Pravotočivá. Krátká a silná. Velký žlábek hluboký a úzký. Malý žlábek široký a mělký.
B konformace. 10 bp na závit. Pravotočivá. Dlouhá a tenká. Velký žlábek široký. Malý žlábek úzký.
Z konformace. 12 bp na závit. Levotočivá. Protáhlá cik-cak struktura. antiC, synG glykosidické vazby.
DNA a RNA (kyselina deoxyribonukleová a kyselina ribonukleová).
Jediní rozdíl mezi nimi je v ribóze.
Enzym váže přechodový stav s relativně vyšší afinitou než substrát nebo produkt. Prefenční vazba přechodového stavu zvyšuje jeho koncentraci (pravděpodobnost výskytu) - to se odrazí ve zvýšení rychlosti reakce.
Proximitní efekt – přiblížení reaktantů. Orientační efekt – enzym zajistí zaujetí vhodné pozice reaktantů vůči sobě. Nukleofilní atak – atakující reaktant by měl být ideálně být v ose s vazbou, k jejímuž rozbití jeho nukleofilní atak povede. Příklad: opět hexokinázová reakce – 6’OH musí být správně natočen vůči γ fosfátu ATP, aby mohl nukleofilní atak 6’O na fosfát proběhnout.
Fyletická speciace, kdy se postupně mění jeden druh jako celek v jiný druh (mění se fenotypové vlastnosti jeho příslušníků).
Při štěpné speciaci se jeden druh mateřský rozpadne na dva či více druhů dceřiných, které se co do svých fenotypových vlastností vyvijí samostatně.
75 – 95 nukleotidů, obsahuje několik nestandartních bazí. Sekundární struktura jetelovitého listu. 4 ramena:
Akceptorové – zahrnuje 5‘ i 3‘ konec, na 3‘ konci se přes OH skupinu navázanou na C2‘ nebo C3‘ribózy posledního nukleotidu (adenylát v sekvenci CCA) váže aminokyselina
Pseudouridinové rameno (TψC) vytváří smyčku obsahující pseudouridin
Dihydrouridinové rameno (DHU) vytváří smyčku obsahující dihydrouridin
Antikodonové rameno vytváří smyčku, ve které lokalizován antikodon – triplet komplementární ke kodonu na mRNA
Vodíkové vazby ribonukleotidů tRNA, zejména na dihydrouridinovém ramenu, vedou i ke vzniku terciární struktury tRNA, důležité při proteosyntéze.
Speciace je proces, kdy vzniká z jednoho druhu jeden či více druhů nových.
Postupné speciace, kam patří většina speciací, trvají dlouhou dobu (dloudo trvá vytvoření reprodukčně izolačních bariér). Př. alopatrická speciace
Okamžité speciace, které mohou proběhnout téměř v jeden okamžik. Př. speciace polyploidizační – v rámci 2n druhu vznikne 4n jedinec v důsledku poruch b. dělení, který se fenotypově liší od svých předku, speciace extinkční -
studium vzorců chování a mechanismů jejich evolučního vzniku
Opraví téměř každé poškození, např. dané navázáním karcnogenu na bázi DNA, nebo pyrimidinový dimerem.
Skenuje se DNA a hledá se distorze šroubovice, nikoli změna primární struktury (na jednotlivých bazích).
U E. coli 4 proteiny Uvr (UV repair?) zodpovědné za tento systém. UvrA*UvrB skenují DNA, za detekci je zodpovědná UvrA, po detekci UvrB rozvine DNA v místě distorze. UvrC (endonukleáza) pak štěpí 8 nukleotidů od leze na 5' straně, 4-5 nukleotidů od leze na 3' straně. UvrD (helikáza) odstraní poškozený úsek. Mezera je zaplněna DNA polymerázou a zalepena DNA ligázou.
U eukaryot až 25 proteinů – XP geny, jejich mutace vede ke zvýšené citlivosti vůči UV → choroba Xeroderma pigmentosum. Transcription-coupled DNA repair – zabrzdí li se RNA polymeráza na chybě v DNA, přijdou opravné proteiny a poškození opraví → RNA polymeráza může fungovat jako senzor poškození DNA.
Báze mohou tvořit vodíkové vazby s více než jen jedním partnerem → H DNA triplex, G kvadruplex (G-kvartet).
Dva řetězce nukleových kyselin spolu interagují na základě komplementárního párování pomocí vodíkových můstků.
V páru je vždy jeden purin a jeden pyrimidin. Párování poskytuje jistou symetrii. C1' uhlíky jsou v obou případech přibližně stejně daleko od sebe.
Páruje spolu adenin s thyminem (2 H-můstky) a guanin s cytosinem (3 H-můstky).
Nestandartní párování antikodónů na kodóny – U v 1. pozici tRNA antikodónu umí číst A i G v 3. pozici kodónu, G v 3. pozici antikodónu umí číst U i C v 1. pozici kodónu, inosin čte C, U, A.
chromozomová speciace – při chromozomové mutaci se změní morfologie nebo počty chromozomů. Starý a nový karyotyp pak nemusí být kompatibilní. Otázkou je, zda to vytváří RIM, nebo se toto vytvoří až po oddělení druhů. Některé typy chromozomových speciací předpokládají spoluúčast většího počtu chromozomových mutací.
polyploidizační speciace – příčinou speciace může být genomová mutace
hybridizační speciace – rekombinační speciace / polyploidizace hybrida
ekologická speciace – u sympatrie, dvě formy druhu se izolují vytvořením prezygotických bariér
etologická speciace – změna v druhově specifickém rozpoznávání partnerů
vikariantní
Původně jednotná populace je rozdělená nějakou bariérou (řeka, pohoří, ...) na dvě srovnatelně velké populace, které se časem geneticky i fenotypově rozrůzní.
Williams a Hamilton
Richard Dawkins zpopularizoval (Sobecký gen)p
Při alopatrické speciaci nový druh vzniká postupně mimo kontakt s původní populací. Reprodukční bariéry se tvoří v oddělení.
Během sympatrické speciace se nový druh formuje na stejném území, na kterém se vyskytuje druh mateřský. Buď došlo k diferenciaci nik, nebo může jeden z druhů druhý druh lokálně či globálně vytlačit.
Dobře je doložena pouze u cichlid v kráterových jezerech.
Začátek jako alopatrická, potom ale zmizí bariéra a dochází k sekundárnímu kontaktu obou vzniklých populací.
Nalezneme ji např. u nepříliš pohyblivých druhů, jejichž příslušníci vytvářejí v rámci svého areálu rozšíření vzájemně sousedící lokální populace.
Tok genů mezi populacemi je omezený, a je zde tendence k odstraňování hybridů vznikajících na „hranici“, čímž se tok genů ještě více omezuje.
Selekce proti hybridům, areál druhu, který se liší prostředím – př. část les a část louka, druh se postupně adaptuje na odlišné části areálu a časem vznikne RIM.
Evoluce druhů má nespojitý charakter a probíhá ve skocích
Eldredge a Gould
vysvětluje se tím absence mezičlánků
punktuacionalistická
Z mateřské populace se oddělí jen velmi malá subpopulace, která dá posléze vzniknout novému druhu.
Je častější než dichopatrická, protože oddělení malé subpopulace je snadnější. Na druhou stranu většina těchto subpopulací zanikne, nebo opět splyne s hlavní populací.
Druhy žijí na stejném území. Jejich rozšíření je ostrůvkovité.
Př. parazit přenášený přímým kontaktem náhodně přeskočí na jiný druh hostitele, který žije na stejném území jako původní hostitel.
Motó Kimura
Při vzniku biodiverzity může mít zásadní vliv genetický drift.
AutoMotif Server – mnoho druhů modifikací
Malá skupina v populaci se oddělí z původní populace a vytvoří novou populaci. Náhodný vzorek alel.
A ring species is a situation in which two populations which do not interbreed are living in the same region and connected by a geographic ring of populations that can interbreed.
Př. racci okolo polárního kruhu.
Během krátké doby dojde k razatnímu zmenšení populace. Kdo přežije je náhoda.
Predikce lokalizace slouží jako nástroj určení funkce. Může usnadnit vývoj nových léků.
Signály jsou sekvenční i strukturní. Máme jaderné, membránové, sekretované, chloroplastové proteiny, proteiny ER apod.
Sekretované a membránové jsou dobře dostupné pro léky. Program PSORT predikuje lokalizaci.
Membránové proteiny jsou důležité, početné, mají málo struktur. Máme 2 typy. Většina z nich má helix(y), ten musí mít okolo 20 hydrofobních AK.
Hledání motivů – Prosite je databáze motivů spojená se Swissprot (Uniprot) databází. Motivy jsou kontrolovány expertem, ne pouze automaticky. Umožňuje hledání motivů v sekvenci a hledání se specifickým motivem. Možnost definovat vlastní motiv.
Profil. Udává nejenom vyskytující se AK, ale i frekvenci jejich výskytu. Je citlivější než pattern. Popisuje větší kusy proteinu, např. doménu. AK se na několika pozicích může lišit.
Pattern. Sekvence musí přesně odpovídat. Regulární výrazy pro biologické sekvence. AK jsou označeny jednopísmenným kódem, mezi AK jsou pomlčky, v hranatých závorkách jsou vyskytující se AK, v zobáčkových zase nevyskytující se AK (nesmí tam být), číslo v závorce udává počet pozic. Jako jediný dovede jednoznačně přidělit či vyloučit.
BLOCKS má princip jako BLAST, automaticky generovaná databáze alignmentů konzervovaných úseků.
PRODOM – oblíbené u strukturních biologů
PFAM – používá HMM, dobře anotovaná, jak dobře proteiny interagují, jestli mají známou strukturu, jak se liší člověk a kytka atd., jde o databázi proteinových rodin, domén
(Nejlepší možný) odhad skutečnosti. Ještě menší přesnost než u experimentálně určených modelů (často) asociována s pravděpodobností s jakou se odhad blíží skutečnosti nebo s ...
Genový tok je předávání genů mezi populacemi, nejčastěji pomoci migrujících jedinců.
V rámci populace je patrně nejdůležitějším zdrojem evolučních novinek (již odzkoušené) a napomáhá udržet genetický polymorfismus populace.
Protiváha genetického driftu. Stačí 1-2 migranti.
genetický posun
Genetický drift jsou změny frekvence alel. Náhodný posun alel. Některé alely se „vytáhnou“ častěji.
Toto kolísání je nápadné zejména v malých populacích. Může dojít k fixaci nebo ztrátě alely. Pokud bude populace dostatečně velká, nezafixuje se to nikdy. Čím větší populace, tím menší efekt driftu.
Jsou i jiné příčiny změny frekvencí jako selekce, mutace, migrace. Neuvažujeme tu selekci.
selective sweep
V okolí výhodné mutace dojde ke snížení genetické variability a zároveň ke zvýšení vazebné nerovnováhy v okolí výhodné mutace. Pokud je selekce výhodná, zafixuje se i blízké okolí.
Membránové proteiny lze dobře predikovat, jejich přesnou strukturu už hůře.
Spolehlivost metod. S vysokou pravděpodobností rozlišují membránové proteiny od globulárních (víc jak 90 %). Správnou topologii stanoví v 70 % případů. Horší je to pro začátky a konce helixů. Úspěšnost se dá zvýšit vytvářením konsensu po použití více metod. Menší pozornost je věnována β barelům, jelikož je jich málo a často jsou bakteriání či mitochondriální. β barely jsou méně hydrofobní než transmembránové.
Antipararelní β listy jsou spojené s nejbližším sousedem. N a C konce mají v periplazmatickém prostoru. Mají lichý počet řetězců (vláken).
Predikce není realita. Některé domény jsou přirozené bez dobře definované struktury. Membránové proteiny lze dobře predikovat. AK mají preference pro výskyt v sekundárních strukturách.
evoluční svezení se, genetic hitchhiking
Evoluční osudy genů ležících na stejném chromozomu se vzájemně ovlivňují. Genetický draft je změna ve frekvenci alely v populaci díky genetické vazbě s jinou alelou (výhodnou či nevýhodnou)
background selection
Dochází k odstranění alel z populace díky genetické vazbě s nevýhodnou mutací.
Vede ke snížení genetické variability, které však není tak výrazné jako v případě selekčního vymetení.
position-specific scoring matrix, position weight matrix, PWM, Pozičně specifická skórovací matice
Je založená na počtu písmen na pozicích.
Pseudo-counts – aby výskyt žádného symbolu nebyl 0.
Matice se využívá jako posuvné okno, které jede podél dotazované sekvence. Sčítá skóre ve sloupcích.
Vážení sekvencí – kvůli tomu, že velké podrodiny mohou negativně ovlivnit výsledky.
Relativně rychlé.
Dotazování je relativně rychlé na implementaci.
Skóre shody jsou statisticky interpretovatelná.
Žádné inzerce nebo delece.
Počet atomů ve struktuře maximálně 99.999 (ribozóm), málo strukturovaný typ souboru, což je nevýhoda při automatické extrakci dat (viz hledání v databázi). Nekonzistentní – SEQRES vs ATOM.
Jsou více strukturované, míň intuitivní pro člověka, ale mnohem čitelnější pro počítač.
mmCIF – Macromolecular Crystalographic Information File
XML – eXtensible Markup Language
Komunikace s DB pomocí stringů je fakt dumm idea!
Doufejme, že se škola také naučila zálohovat.
PSI-BLAST = Position Specific Iterative BLAST
PSI-BLAST je profilová metoda využívající Position Specific Scoring Matrix (PSSM).
Schopný identifikovat 3krát více 30% homologů než BLAST.
Je rychlý, protože využívá heuristiky BLAST.
Umožňuje PSSM na velkých databázích.
Posun profilu. Vysoká senzitivita, z toho plyne mnoho false positive, biased profil, který ze začlení do následujícího cyklu.
Hidden Markov Model
Evoluční soupeření probíhá na úrovni alel.
Richard Dawkins – model modrovousů.
U pohlavně se rozmnožujících organismů se fitness nedědí, je dáno genotypem (fenotypem), který se vytváří u každé generace de novo. Alely se ale předávají v nezměněné formě. Alela, která naprogramuje svůj organismus tak, aby byl co nejúspěšnější bude do další generace předána ve více kopiích než jiné alely téhož loku. Modrouvousovské geny jsou velmi rozšířené a úspěšné, nepřeváží proto, že populace, která je nese neuspěje v kompetici.
Některé alely se dokáží šířit na úkor jiných alel. Vnutí jim svou sekvenci, podle které se musí opravit. Jedná se o tzv. sobeckou DNA.
Patří sem procesy odpovědné za šíření jednotlivých variant repetitivních úseků DNA v rámci genomu a u pohlavně se rozmnožujících organismů i v rámci celého genofondu.
Př.
Sekvence jsou rozděleny na slova (např. 3 AK). Nemusí být kompletní shoda. Slova jsou skórována vůči databázi všech slov. Je senzitivnější, ale méně selektivní. Má na začátku více slov.
Slova jsou modifikována. Nejlépe skórující páry jsou podrobeny dynamickému programování, které produkuje výsledné skóre a alignment. Vzhledem k rostoucí databázi je třeba algoritmus stále modifikovat.
BLAST hledá příbuzné sekvence, nejpříbuznější však mohou chybět. Dělá lokální alignment, takžé často skóruje nejlépe vzdálené příbuzné.
Verze na všechno možné.
Jedna alela je přednostně vytlačena do pólové buňky alelou, která se dostala do vajíčka.
Při samičí meióze vzniknou 4 buňky, 1 dává vznik vajíčku a 3 pólové buňky
individuální výběr. Je výhodný pro jedince. Bývá nejsilnější. Ve většině případů silnější než skupinový. Zabýval se jím Darwin a je stále považovaný za nejdůležitější. Např. sexualita je vlastnost vzniklá tímto výběrem.
skupinový výběr. Vlastnosti výhodné pro skupinu, ale ne vždy pro jedince. Soupeří mezi sebou populace. Přítomen tam, kde se vytváří velké množství samostatných sociálních skupin stád, tlup, hejn.
příbuzenský výběr. Nelze jej zaměňovat se skupinovým. Existence altruistického chování, kdy jedinec snižuje své fitness ve prospěch celku. Určené primárně na pomoc blízkým příbuzným. Jde o zvýšení inkluzivní zdatnosti. Soupeři mezi sebou rody. Sobci v altruistických skupinách nikdy nevymizí, ale zároveň se jejich počet ani nezvyšuje.
druhový výběr. jednotlivé druhy spolu soupeří o to, který bude odštěpovat více dceřiných druhů, a o to, který bude s menší pravděpodobností podléhat extinkci.
mezidruhový výběr. pokud je znak, který je pro jedince neutrální a druhu prospívá, může se tento znak prosadit. Soutěží se o lepší využití zdrojů.
celospolečenstvový výběr. dosti pochybné, že by to mohl být předmět evoluce.
Znaky výhodné pro vyšší jednotku, ale neutrální pro jedince se mohou fixovat na vyšších úrovních.
Pseudoaltruistické chování jedinců stejného biologického klonu v eusociálních společenstvech je produktem individuálního, nikoliv skupinového výběru.
BLAST je rychlý, dobrý s proteiny, dobré lokální a krátké globální alignmenty, vytváří HSP (high-scoring páry).
Na druhou stranu může minout dobrá zarovnání kvůli rychlosti, hledá sourozence.
FASTA je pomalejší, lepší s DNA než BLASTN, vytváří Smith-Waterman alignmenty, hledá sestřenice a bratrance.
Bioinformatické databáze jsou úložiště dat, volně dostupné pro kohokoliv, snadné k nalezení, někdy placené, lze je třídit na nukleotidové, RNA, proteinové, strukturní, rostlinné, imunologické apod.
DNA databáze – GenBank, EMBL, DDJB, soupeří o to, kdo bude mít více uživatelů = pozitivní konkurence
Proteinové databáze – Uniprot, což je Swissprot (anotovaná) a TrEMBL, GenPept (GenBank), normální protein je dlouhý mezi 200 – 400 AK
Genomové nukleotidové databáze – popisují komplexně genomy, např. bakteriální, lidské, obsahují nukleotidové sekvence a mapování, z genové mapy umíme předpovědět funkci
Strukturní databáze – dělíme na primární, added-value a odvozené databáze
Jde o úložiště experimentálních dat struktur makromolekul pomocí krystalografie, NMR a elektronové mikroskopie
Struktury se zapisují do PDB formátu, má dvě části, v první popisuje, co je to za strukturu, kdo je autor, z jakého je organismu, ve druhé části, tzv. atomu, je zapsaná informace o struktuře, definice je sloupcová, nejprve je X, Y a Z souřadnice, pak okupance (v kolika % případů se vyskytuje atom v této dané konformaci, většinou 1 – statická struktura, někdy krystal vyroste ve dvou různých směrech), temperature faktor nám říká o dynamice proteinu (plochu, na jaké se atom vyskytuje, čím větší číslo, tím větší plocha, tím větší neurčitost, kde atom vůbec je, buď je struktura špatně určená, nebo je dynamická, flexibilní)
Problémy s PDB: počet atomů ve struktuře je omezený (99 999, problém s ribozómem), jde o málo strukturovaný typ souborů, struktury jsou pouze modely, které nejlépe vyhovují experimentálním datům, změnit data může jen autor (a co když umře?), každá struktura obsahuje nějaké chyby, PDB nemůže odmítnout uložit žádná data, je nekonzistentní (SEQRES, kdy jsou vypsané aminokyseliny a ATOM, což je v podstatě to samé s dalšími informacemi, ale často se neshodují) → slepě nevěřit
Jaké typy analýz lze provádět se sekvencí proteinu kromě alignmentu? Analýza lokalizace v buňce, analýza domén a sekvenčních motivů, predikce posttranslačních modifikací
Nové strukturní formáty místo PDB – mmCIF a XML, jsou více strukturované, čitelnější pro počítač, ale méně intuitivní pro člověka
3 velké strukturní databáze (stejně jako u sekvencí), spojuje je WWPDB: PDBj (japonská), PDBe (evropská), RCSB
Protein Data Bank PDB – založena roku 1971 Hamiltonem, na počátku zde bylo 7 struktur na magnetických páscích, dnes jde o konsorcium 3 institucí, dnes asi 129 000 struktur distribuují přes internet a updatují databázi 1x týdně, roste každý den
Databáze lákají návštěvníky skrze další služby, různé analýzy, prohledávání strukturních motivů apod.
Změna konformace (vazba ligandu...) hledání strukturních motivů klasifikac struktur odhalování evolučnich vztahů
struktura lépe konzervovaná než sekvence umožňuje odhalovat homologie v sekvenčí twilight (midnight) zóně databáze mohou obsahovat chyby vylepšuje zarovnání více sekvencí predikce struktury a metodiku zarovnání obecně
Při meiotickém tahu se do buněk přednostně dostává jedna alela a druhá se buď nedostává vůbec, nebo s menší frekvencí.
Používá globální alignment. Rychlá heuristická metoda. Na začátku srovnává jen malé kousky, a těch je omezené množství. Nesrovnává celé sekvence. Porovnává slova s databází. Využívá Smith-Watermana.
Rozšíření hešování pro více výskytů stejného řetězce. Využívá 2 pole a a b:
Urychluje zarovnání 2 sekvencí, zatímco umožňuje plný alignment jen pro potenciálně vysoce skórující dvojice sekvencí.
Databáze sekvencí roste exponenciálně. Známe optimální algoritmus pro podobnost sekvencí, ale má kvadratickou složitost (Needleman-Wunsch, Smith-Waterman). Potřebujeme algoritmus s lineární složitostí v nejhorším případě.
Sequential Structure Alignment Program
gametický tah
Výsledkem samičí meiózy jsou 4 spermie. Ze začátku jsou spermie propojené cytoplasmatickými můstky. Mohou si tak snadno do určité míry vyměňovat třeba mRNA.
Občas se stává, že dochází k likvidaci spermií, které nenesou upřednostňovanou alelu.
Př. t-haplotyp u myší
Strukturovaný soubor dat v počítači, je možné je prohledávat a stahovat. Databáze se tvoří, protože se jinak data ztrácejí, jde o jednotný zdroj informace pro další analýzy, jsou snadno dostupné pro kohokoliv, kontroluje se v nich kvalita dat
Validace – ptáme se, jak normální je model (jak podobný je jiným strukturám v PDB, jak naplňuje chemické a fyzikální vlastnosti?), sledujeme délky vazeb, úhly, Ramachandranův diagram, existují aplikace WhatCheck a ProCheck, které říkají, jestli je něco podezřelého,
sledujeme i jak moc odpovídá model experimentálním datům, které se ukládají spolu s modelem, EDS (electron density server) tato data umí znovu spočítat, vytvořit strukturu z experimentálních dat a říct, jak moc to lícuje, pokud je odchylka více než 10 %, tak na to upozorní
PDBe se snaží validovat databázi, vyhodí nám takový graf, jak daleko od průměru je naše struktura (pod či nad průměrem), taky nám to vyhodí graf, jak dobře odpovídá struktura experimentálním datům
Added-value databáze – PDB sum, ukáže nám Ramachandranův diagram, ukazuje nám „Guinessovy knihy“, největší struktury atd.
Specializované databáze – PISA nám ukazuje kvartérní strukturu proteinu
Cílem superpozičních algoritmů je nalézt superpozici (rotace a translace) jedné struktury nad druhou ústící v minimální RMSD.
Obvykle se optimalizuje superpozice atomů (vzdálenost). Je měřena jako RMSD Cɑ atomů. Nalézají se takové rotace, při které se minimalizuje vzdálenost mezi atomy. Uvádí se v ångströmech.
RMSD je parametr, který popisuje kvalitu zarovnání, je citlivý na lokální změny a koreluje s délkou zarovnání. Počítá se pro celou strukturu.
Given a pairing/alignment between atoms/amino acids of the two compared structures, superposition minimizing RMSD (based on the paired atoms) can be computed in linear time (Kabsch algorithm).
Časová složitost algoritmů.
Metoda „rozděl a panuj“ - aplikace a analýza složitosti
Dynamické programování.
Binární vyhledávací stromy, vyvažování, haldy.
Třídění
Grafové algoritmy
Algoritmy vyhledávání v textu
Algebraické algoritmy
Evoluční tahy jsou procesy probíhající na úrovni nosičů genetické informace. Působí společně s přirozeným výběrem a dalšími mechanismy.
V určitých pozicích nukleotidového řetězce vznikají přednostně určité typy mutací.
kombinatorická expanze
Principy a základy implementace objektově orientovaných jazyků
Normální formy, referenční integrita. Základy SQL.
Unix – základní pojmy (systém souborů, komunikace mezi procesy), shell (syntaxe, programové konstrukty), základní utility.
Stabilizující selekce odstraňuje jedince s extrémními hodnotami znaku.
Disruptivní selekce odstraňuje jedince s průměrnými hodnotami a zvýhodňuje extrémy.
Usměrňující selekce je posun maxima určitým směrem, obvykle jen na přechodnou dobu - reakce na změnu podmínek.
GeneBank. Anotovaná sbírka všech veřejně dostupných sekvencí DNA a jejich proteinových transkriptů včetně sekvencí mRNA s kódujícími oblastmi, segmenty genomické DNA s jedným nebo více geny, a ribozomální RNA genové klastry. Spravované NCBI, operované EBI a DDBJ (DNA Data Bank of Japan).
RefSeq. Reference Sequence databáze je spravovaná sbírka DNA, RNA a proteinových sekvencí vytvářená NCBI.
Uniprot. Universal Protein Resource = PIR + Swiss-Prot + TrEMBL. Projekt odstartoval v roce 2002 v EBI, SIB (Swiss Institute of Bioinformatics) a PIR (USA).
Swiss-Prot. SIB, a později EBI. Minimální redundance, manuálně anotovaná a kontrolovaná.
TrEMBL. Translated EMBL Nucleotide Sequence Data Library. Není kontrolovaná. Vytvořena, protože sekvenční data začaly být vytvářené takovým tempem, které přesahovalo možnosti Swiss-Protu.
PROSITE. Databáze proteinových domén, rodin, a funkčních míst. Manuálně spravovaná SIB. Zahrnuje patterny a profily definované skupinami, obsahuje nástroje k detekci motivů. Může být využita k identifikování nových funkcí nebo funkcí neznámých proteinů (princip podobnosti).
Pfam. Databáze proteinových rodin založená na zarovnání více sekvencí založených na hidden HMM. HMM je součást databáze. Jak manuálně spravovaná (Pfam-A) a automaticky klasifikovaná (Pfam-B).
Protein Databank (PDB). Primární zdroj struktury a souvisejících funkcí. Původně jen informace o proteinech, ale dneska i informace o strukturách DNA a RNA, a též informace o komplexech. Změnit data může jen autor (a co když umře?), každá struktura obsahuje nějaké chyby, PDB nemůže odmítnout uložit žádná data. Struktury v PDB jsou pouze modely, které nejlépe vyhovují experimentálním datům.
SCOP (Structural Classification of Protein Structures). Udržovaná hierachická klasifikace (zlatý standard) vytvořený nad PDB. Podle domén. Dobrý pro testování podobnostních metod.
CATH (Class, Hiearchy, Topology, Homologous superfamily). Poloautomatická, hiearchická klasifikace struktur proteinových domén. Klasifikační procedura používá kombinaci automatických a manuálních technik, které zahrnují výpočetní algoritmy, empirické a statistické důkazy, přehledy literatury a analýzy expertů.
Distance mAtrix aLIgment
založená na matici vnitroreziduálních vzdáleností, 2D reprezentaci 3D struktury nezávislé na systému souřadnic
hlavní myšlenka: podobné struktury sdílejí podobné vnitroreziduální vzdálenosti
přirozený výběr
Přirozený výběr je proces nerovnoměrného předávání alel pocházejících od jednotlivých individuí do genofondu následujících generací prostřednictím potomků.
Zahrnuje minimálně výběr přírodní a výběr pohlavní.
Podmínky fungování selekce:
Kompenzuje mutační tah. Dochází ke vzniku mutací během reparačních procesů.
1707-1778 Carl Linne - první bioinformatik podl’a definície Janet Thornton
1956 Fred Sanger - první sekvence (insulin)
1957 Perutz and Kendrew - první proteinová struktura (hemoglobin)
1965 Margarett Dayhoff - první sekvenční databáze
1969 ARPANET - projekt Advanced Research Project Agency (ARPA) při US Department of Defence - spojuje 4 vojenské laboratoře na západním pobřeží
1970 Needlman-Wunsch algoritmus sekvenčního srovnávání
1971 první strukturní databáze
1981 - BITNET (“Because it’s time”) - spojuje univerzity
1982 - ARPA představuje Transmission Control Protocol (TCP) a Internet Protocol (IP) - umožˇnuje spojit počítače, nenáležící do stejné sítˇe
1987 Hwa A. Lim - “bio-informatique”
1988 Hugo projekt; NCBI založeno
1989 WWW CERN umožˇnuje vidˇet obsah aniž by musel být stažen do počítače
1990 Altschul, Lipmanet al. - BLAST
1992 Genbank (NCBI)
1995 First genome - Haemophilus influenze, první bakteriální genom
Nejvetší genom - Amoeba dubia, 670 Gb
- Vliv internetu – 1969 ARPANET – síť spojující vojenské laboratoře Z pobřeží USA, síť byla 1981 poskytnuta univerzitám jako BITNET, 1982 pak umožňuje spojovat počítače nenáležící do stejné sítě, 1989 – WWW – CERN umožňuje vidět obsah, aniž by musel být stažen do PC
Můžeme je měřit, sekvenovat, tvořit 3D struktury, sbírat genomická data, zkoumat příbuzenské vztahy, interakce, zkoumat bibliografická data, EST (expressed sequence tag), SNP (single-nucleotide polymorphism) – bio data jsou jako teenage sex, všichni o něm mluví, ale nikdo neví, jak toho dosáhnout.
Genomická data – dříve mnohem dražší, 228 000 lidských genomů sekvenováno v roce 2014 (7 x 1015 bazí – mp3 hrající 2000 let :D, asi 1 PB, lidský mozek má paměť velikou 2,5 PB)
Strukturní data - V současné době 127 000 struktur – každý rok přibývá asi 10 000 struktur (proteiny apod.)
PubMed – více než 26 mil. článků
Databáze a ontologie.
Sekvence. Vznik a údržba databází a jejich rozhraní se světem (servery), integrace databází, biologicky relevantní ontologie (Gene Ontology). Sekvenční analýza – zarovnání sekvencí, hledání podobných sekvencí v databázi, hledání motivů, domén a funkčních míst v proteinech i nukleových kyselinách, predikce struktury, fylogenetika a populační genetika. Modely evoluce, hledání fylogenetických vztahů, ověřování kvality stromů, segregační a spojovací analýzy.
Genomy. Databáze a ontologie. Fylogenetika a populační genetika – konstrukce map, komparativní metody, analýza genomů – sestavení, anotace genomů i chromozomů, hledání genů, alternativní sestřih, analýza EST, komparativní genomika.
Struktury. Databáze a ontologie. Strukturní bioinformatika.
Text. Databáze a ontologie prohledávání textu a dat – hledání, třídění, analýza a predikce na základě textů a dat uložených v databázi bibliografických i jiných.
Systémová biologie – pokus o integraci všech předchozích typů dat směřující k celostnímu přístupu k buněčné a molekulární biologii, analýza interakcí, metabolických drah a signálních kaskád, simulace a matematické modelování.
Veškeré typy výběru mohou existovat ve 2 zákl. formách:
substition matrix, scoring matrix
Point Accepted Mutation
Počet bodů vyjadřuje, jak jsou pozorované změny časté vůči očekáváným náhodným změnám. Kladný počet bodů – změny jsou častější než očekávané, záporný počet bodů – změny jsou méně časté.
PAM matice je založená na experimentálních datech. Vytváří se z globálního aligmentu velmi podobných sekvencí. Získáme data o náhradách aminokyselin z podobných sekvencí (PAM 1) a z těchto znalostí vyvodíme matice pro větší evoluční vzdálenosti (PAM n).
BLock SUbstitution Matrix
Všechny tabulky BLOSUM vycházejí z experimentálních dat. Jsou založeny na lokálních aligmentech bloků aminokyselin s definovanou sekvenční identitou.
Negativní selekce - odstraní se jedinci bez požadované vlastnosti.
Pozitivní selekce - podpora jedinců s požadovanou vlastností.
Působením pohlavního výběru jsou selektováni jedinci s větší sexuální zdatností.
Vede k rozdílné evoluci morfologických znaků u obou pohlaví, ke vzniku druhotných pohlavních znaků (epigamních znaků), a tedy často i velmi nápadného pohlavního dimorfismu.
Pohlavní výběr mezi jedinci jednoho druhu, obvykle samci. Nestačí jen přežít, je třeba se více rozmnožit.
Jsou dva způsoby, jak toho dosáhnout:
Vysvětluje existenci excesivních znaků (př. páv), které snižují životaschopnost svým nositelům, ale samečka to zvýhodňuje.
Mutační a reparační tah zodpovídají v největší míře za evoluci celkové struktury genomu, tedy za jeho zmenšování či zvětšování.
P-value je pravděpodobnost, že bude skóre x nebo vyššího dosaženo náhodou.
E-value je pravděpodobnost, že bude dosaženo skóre x nebo vyššího náhodou v databázi dané velikosti (E-value = P-value x N).
Expect value (E-value) je parametr popisující počet záznamů, které můžeme nalézt náhodou při prohledávání databáze určité velikosti.
Př. E-value = 1 znamená, že v databázi aktuální velikosti můžeme předpokládat 1 shodu s podobným skóre čistě náhodou. Čím je E-value nižší či k 0 bližší, tím signifikantnější ta shoda je.
V podstatě shodné krátké alignmenty budou stále mít relativně vysoké E-value.
Z-skóre udává kolik stand. odchylek je pozorované skóre vzdálené od průměr. skóre.
| Z > 15 | statisticky významné skóre, téměř jistě homolog |
| Z = <5;15> | velmi pravděpodobně homolog |
| Z < 5 | může, ale nemusí být homolog |
definice oboru 🙈
sekvenční srovnávání 🙈
hledání podobných sekvencí
hledání domén a motivů
databáze
strukturní srovnávání
predikce struktury makromolekul
fylogenetika - stavba stromů, základní metody tvorby stromů (ML, MP, NJ, Bayes), bootstrap analýza
Pokud jsou dvě alely současně pozitivně selektované, rychlost jejich šíření je menší než kdyby se šířily samostatně.
Pro fixaci alely je třeba, aby vymřeli jedinci bez této alely. Pokud ale mají jinou pozitivní alelu, vymírají pomaleji.
V komplexních systémech rozhodují o osudech nových mutací především evolučně stabilní strategie. Nemůže být převálcována jinou strategií.
Strategie jestřab (popere se o potravu) a holubice (rozdělí se o potravu). Kdo vyhraje? Mnoho jestřábů – nevýhodné pro všechny. Mnoho holubic – výhodné pro jestřáby. Zastaví se to na rovnovážné frekvenci. Mutant, který se chová jednou jako holubice, jindy jako jestřáb, vyhrává.
Přírodní výběr selektuje jedince s vyšší plodností a životaschopností.
Minimální entropie popisuje variabilitu sloupce. Čím nižší entropie, tím nižší variabilita. Zcela konzervovaný sloupec má skóre 0.
Pravděpodobnost sloupce předpokládá, že jednotlivá rezidua jsou navzájem nezávislá v rámci sloupce i mezi jednotlivými sloupci. Pravděpodobnost i-tého sloupce je rovna produktu pravděpodobností výskytu rezidua a umocněného pozorovaným počtem pro pozorované reziduum a v i-tém sloupci. Když to převedeme na logaritmus dostaneme: CME(Ai) = - suma(cia logpia).
Výsledná minimální entropie je rovná součtu minimálních entropií sloupců.
Skóre sloupce se spočte jako součet skóre všech dvojic reziduí v daném sloupci. Pro každou dvojici nalezneme skóre ve zvolené skórovací tabulce. K získání výsledného skóre sečteme skóre všech sloupců.
Nevýhoda. Relativní rozdíl ve skóre mezi správným zarovnáním a nesprávným zarovnáním se snižuje s rostoucím počtem sekvencí v zarovnání, avšak rostoucí počet sekvencí by nám měl způsobit vzrůst relativního rozdílu ve skóre.
Algoritmus slouží k hledání optimálního lokálního zarovnání. Dostaneme jej úpravou Needleman-Wunschova algoritmu.
r-selekce - selekce k větší růstové rychlosti
K-selekce - selekce k větší konkurenceschopnosti
Názvy podle tradičního označení konstant v logistické rovnici.
dN/dt = rN(K – N)/K
N = počet jedinců v populaci, r = růstová rychlost, K = kapacita prostředí, odrážející maximální počet jedinců, které dané prostředí dokáže uživit
Náhodný výběr vede k selekci rychle se množících jedinců.
Zdatnost nosičů určité alely závisí na jejich četnosti v populaci. Jde o jeden z nejdůležitějších mechanismů pro udržení polymorfismu v populaci.
Pozitivní – konformita samic – Samice si vybírají podle toho, koho si vybere nejvíce samic. Předají to svým potomkům. Ti budou opět žádání. – včely se naučí létat na žluté kytky, proto je výhodné být žlutá.
Negativní – vstavači – 2 formy vstavačů, které nemají opylovačům, co nabídnout, jsou stejně zastoupené. Pokud bude jedné formy více, čmeláci se na ní naučí nelétat a bude to nevýhodné (červený). – dravec a kořist – Dravec se přednostně zaměří na nejpočetnější kořist. Postupně se její stav sníží a nejvýhodnější bude jiná kořist.
multiple sequence alignment, MSA
Multiple Sequence Alignment (MSA) je srovnávání tří a více sekvencí podobné délky. Nelze použít dynamické programování, protože by to mělo moc velkou časovou složitost.
Při získávání zarovnání více sekvencí je důležitější skórování než algoritmus.
Optimální řešení může být dosažené iterativním vylepšováním předešlých řešení. Nejprve použijeme heuristiku a potom stále dokola odebíráme a znova přidáváme sekvence.
Multiple Alignment using Fast Fourrier Transformation
dot matrix analysis
Obvykle se počítá pro několik po sobě jdoucích nukleotidů (aminokyselin). To se nazývá okno (window). Pole se označí jen když je dosaženo určitého množství shod (threshold).
Dot plot je vhodný k odhalení repetic a oblastí s nízkou komplexitou (low-complexity region).
Needleman-Wunschův algoritmus je podobný výpočtu editační vzdálenosti. Na rozdíl od ní hledá, jak moc jsou si sekvence podobné. Snaží se najít globální zarovnání dvou sekvencí. Při výpočtu skóre využíváme skórovací tabulky.
Intersexuální selekce je dána samičí volbou. Je zde rozdíl v množství energie vložené do vychování mláďat.
Samci mohou zvyšovat počet svých potomků zvýšením počtu sexuálních partnerek.
Samice mohou zvyšovat kvalitu potomstva výběrem samce.
Clustal W je podobný algoritmu Feng&Doolittle.
Vezme dvě nejpodobnější sekvence, přidá k nim další nejpodobnější atd. – vznikne guide tree, postupně srovnává
Vážíme podsekvence, abychom kompenzovali zkreslenou reprezentaci ve velkých podrodinách. Příspěvěk sekvencí k MSA je vážený jejich vztahy v předpokládáném evolučním stromě – váhy jsou určené vzdáleností každé sekvence od kořene.
Bodovací tabulku vybíráme podle příbuznosti sekvencí – blízce příbuzné BLOSUM 80, vzdáleně příbuzné BLOSUM 50.
Ceny mezer jsou vyšší, pokud nejsou mezery v dané pozici, ale jsou v nějaké blízké pozici. Takže mezery jsou tlačeny do těch samých míst. Bodování otevření mezery je pozičně specifické a jsou násobené modifikující funkcí reziduí pozorovaných v dané pozici.
Pro kostrukci guide tree se využívá mBed algoritmus.
Každá sekvence je nahrazená vektorem s n prvky, kde každý prvek je vzdálost do jedné z n referečních sekvencí.
Vektory se klastrují pomocí UPGMA nebo K-means. Alignmenty profilů se dělají pomocí skrytých Markovských modelů (HHalign balík).
Posloupnosti a řady, konvergence, Cauchyovské posloupnosti. 🙈🙈
Reálně funkce jedné proměnné. 🙈🙈
Limita v bodě a spojitost. 🙈🙈
Derivace funkcí 🙈🙈
Extrémy funkcí. 🙈🙈
Aplikace, např. průběh funkcí, Taylorův polynom. 🙈🙈
Integrální počet. 🙈🙈
Primitivní funkce a Newtonův integrál. 🙈🙈
Určitý (Riemannův) integrál a jeho použití. 🙈🙈
Preferuje samce, kteří se dokáží prosadit proti ostatním samcům. K tomu mají vyvinuté druhotné pohlavní znaky.
Je dána několika faktory:
Binární relace, ekvivalence a částečná uspořádání. 🙈
Kombinatorické počítání 🙈
Teorie grafů. 🙈
Základní pojmy teorie grafů: grafy a podgrafy 🙈
Izomorfismus 🙈
Stromy a jejich základní vlastnosti 🙈
Náhodné jevy 🙈
podmíněná pravděpodobnost 🙈
nezávislost náhodných jevů 🙈
Náhodné veličiny 🙈
střední hodnota 🙈
linearita střední hodnoty 🙈
bodové odhady a testování hypotéz 🙈
Soustavy lineárních rovnic, metody řešení. 🙈
Matice 🙈
Základní algebraické struktury 🙈
Základní vlastnosti konečně generovaných vektorových prostorů, vektorové podprostory. 🙈
Báze a dimenze. 🙈
Lineární zobrazení 🙈
Skalární součin a norma. 🙈
Determinanty 🙈
Vlastní čísla a vlastní vektory matic. 🙈
Druhotné pohlavní znaky plní funkci indikátorů kvality jedince.
Znaky nefalšovaně vypovídající o zdatnosti samce (kdyby se brzy fixoval u všech, pohl. výběr by skončil), proto samci mají opatření proti podvodům.
Pro každé přirozené číslo máme přiřazené jedno reálné číslo.
ireflexivní = vrchol x není sám s sebou v relaci
Matice, která není regulární, se nazývá singulární.