9) Areny
Created by Martin Krejzek
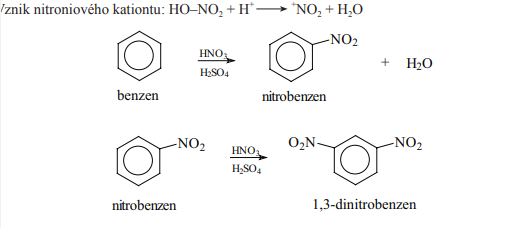
Nitrace
- Provádí se za přítomnosti nitrační skupiny
- Vznikají nitrosloučeniny s funkční skupinou NO2-
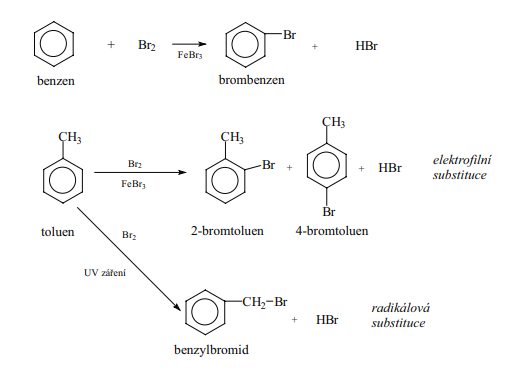
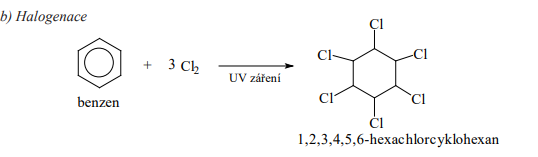
Halogenace
- Halogen vstupuje do aromatického kruhu a vznikají tzv. halogenderiváty
- Působením katalyzátoru se heterolyticky štěpí vazba X-X na X- A X+
- Elektrofilním činidlem je kationt X+ (Cl+, Br+)
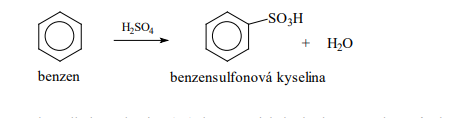
Sulfonace
- H2SO4 => OH- + HSO3+
- HSO3+ se naváže na aromatický uhlovodík (jedná se o elektrofilní činidlo)
Procvičení



Alkylace
- Je zavedení alkylové skupiny (R-) do aromatického kruhu
- Provádí se působením halogenalkanů
- Elektrofilním činidlem je alkylový kation R+
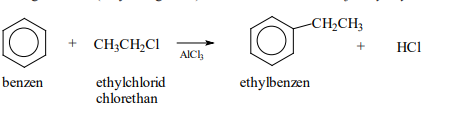
Elektrofilní substituce
- Elektrofilní činilo napadá benzenový kruh (oblak Pí elektronů)
Struktura benzenu
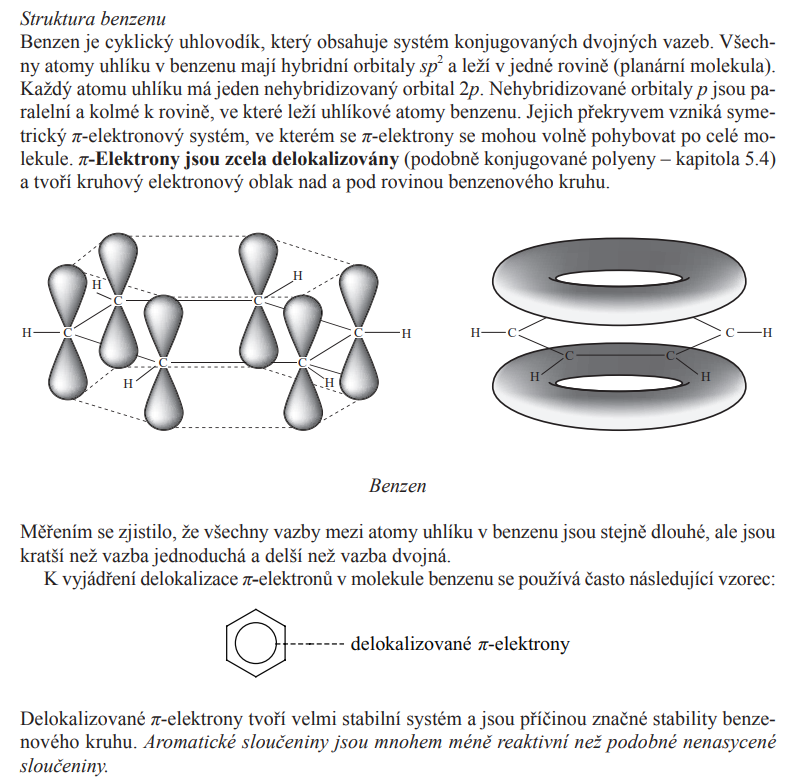

Benzen
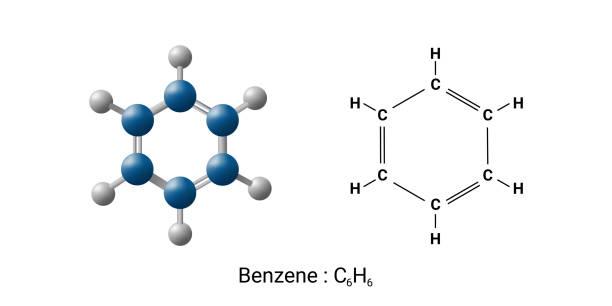
- Je nejtypičtější aromatický uhlovodík
- Kapalina
- Systematicý název:
- cyklohexa - 1,3,5 - trien
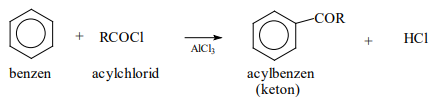
Acylace
- Je zavedení acylové skupiny (-CO-R) do aromatického kruhu
- Provádí se reakcí s acylhalogenidy
- Při této reakci vznikají ketony
9) Areny
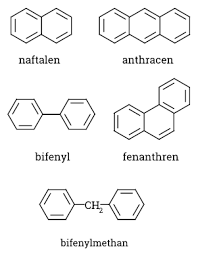
- Látky obsahují tzv. aromatické jádro
Katalytická hydrogenace
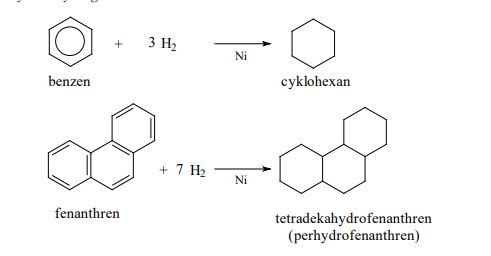
Fyzikální vlastnosti
- Mají kapalné | pevné a plynné
- Kondenzované areny jsou většinou pevné
- Jsou nepolární
- Jsou aromatické a hořlavé
Poloha arenů
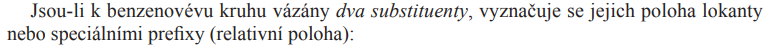
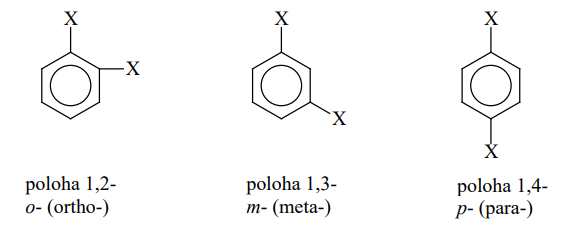
Názvosloví
- Substituenty 1. třídy vedou ke vzniku 2 produktů
- OH; - x; - R
- Poloha 2 (o = ortho) a 4 (p = para)
- Substituenty 2. třídy způsobí vznik jednoho produktu
- COOH; NO2; CHO; CN;
- Poloha 3 (m = meta)
- Číslování je pevně dáno
Halogenace
Struktura arenů
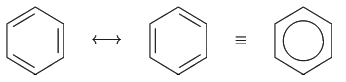
- Nemají násobné vazby
- Uhlík v arenech je pouze třívazný
- Čtvrtý elektron se pohybuje v p orbitalu a vytváří tzv. delokalizované Pí elektrony
- Pouze 3 se tentokrát podílí na struktuře aromatického jádra
- Orbital p má tvar prostorové osmičky a proto se pohybují nad a pod rovinou toho aromatického jádra
Chemické vlastnosti
- Typickou reakcí arenů je elektrofilní substituce
Oxidace

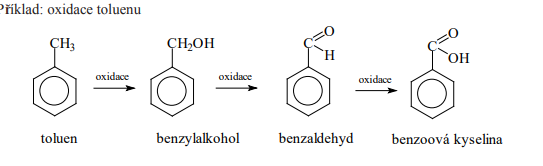
Nejvýznamnější prvky
Aryly
- = Uhlovodíkový substituent z aromatického uhlovodíku
Aryly
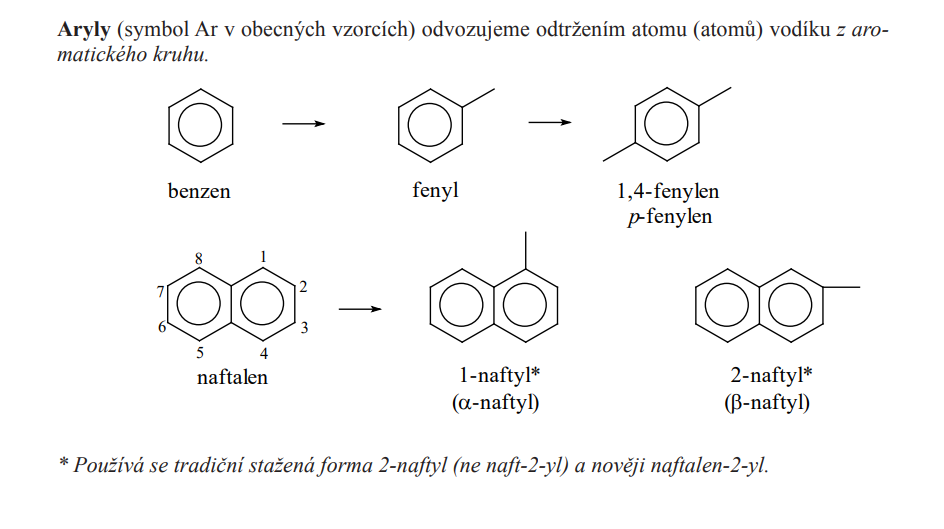
Reakce
Radikálové reakce
Radikálová substituce
